题目内容
下列表述正确的是
A.0.1mol·L-1Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
B.0.1mol·L-1CH3COONa溶液中:c(Na+)=c(CH3COO-)+c(OH-)
C.浓度均为0.1mol·L-1的CH3COONa、NaOH和Na2CO3三种溶液的pH大小顺序:
pH(NaOH)>pH(Na2CO3)>pH(CH3COONa)
D.向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至中性,溶液中离子浓度的关系:
c(CH3COO-)>c(Na+)>c(OH-)=c(H+)
【答案】
C
【解析】A不正确,不符合质子守恒,应该是c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3).B不正确,不符合电荷守恒,应该是c(Na+)+c(H+)=c(CH3COO-)+c(OH-)。酸越弱,相应的钠盐越容易水解,醋酸的酸性强于碳酸的,所以碳酸钠的碱性强于醋酸钠的,C正确。D不正确,根据电荷守恒可知,c(CH3COO-)=c(Na+)>c(OH-)=c(H+),答案选C。

练习册系列答案
相关题目
水是最宝贵的资源之一。下列表述正确的是
A.H2O的电子式为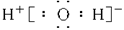 |
| B.4 ℃时,水的pH=7 |
| C.D216O中,质量数之和是质子数之和的两倍 |
| D.273 K、101 kPa,2.4L水所含分子数约为6.02×1023 |

 3R(g); △H>0,下图表示外界条件温度、压强的变化对上述反应的影响。下列表述正确的是
3R(g); △H>0,下图表示外界条件温度、压强的变化对上述反应的影响。下列表述正确的是
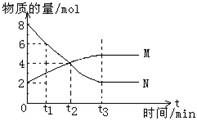
 2M
2M  )+c(HCO
)+c(HCO )
+ c(H2CO3)
)
+ c(H2CO3)