题目内容
【题目】NF3分子中的中心原子采取sp3杂化,下列有关叙述正确的是( )
A. NF3分子的空间构型为三角锥形
B. NF3分子的空间构型为平面三角形
C. NF3分子的N—F键夹角与CH4分子中的C—H键的夹角相等
D. NF3分子是非极性分子
【答案】A
【解析】A.氮原子价层电子对个数=3+![]() ×(5-3×1)=4,所以N原子采用sp3杂化,N原子含有1个孤电子对,空间构型为三角锥形,故A正确;B. 氮原子价层电子对个数=3+
×(5-3×1)=4,所以N原子采用sp3杂化,N原子含有1个孤电子对,空间构型为三角锥形,故A正确;B. 氮原子价层电子对个数=3+![]() ×(5-3×1)=4,所以N原子采用sp3杂化,N原子含有1个孤电子对,空间构型为三角锥形,故B错误;C. CH4分子中的C—H键的夹角等于109°28′,NF3分子中含有1个孤电子对,N—F键夹角小于109°28′,故C错误;D. 氮原子价层电子对个数=3+
×(5-3×1)=4,所以N原子采用sp3杂化,N原子含有1个孤电子对,空间构型为三角锥形,故B错误;C. CH4分子中的C—H键的夹角等于109°28′,NF3分子中含有1个孤电子对,N—F键夹角小于109°28′,故C错误;D. 氮原子价层电子对个数=3+![]() ×(5-3×1)=4,所以N原子采用sp3杂化,N原子含有1个孤电子对,空间构型为三角锥形,正负电荷的重心不重合,NF3分子是极性分子,故D错误;故选A。
×(5-3×1)=4,所以N原子采用sp3杂化,N原子含有1个孤电子对,空间构型为三角锥形,正负电荷的重心不重合,NF3分子是极性分子,故D错误;故选A。

练习册系列答案
相关题目
【题目】下列实验操作和现象对应的结论错误的是
选项 | 实验操作和现象 | 结论 |
A | 向溶液X中滴加BaCl2溶液,有白色沉淀生成 | 溶液X中可能含有SO42- |
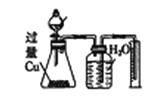
B | 物质的量之比为2:3的稀硝酸和稀硫酸
| 反应结束后,锥形瓶中溶液的溶质是CuSO4,集气瓶中收集到的气体是NO |
C | 向1mL浓度均为0.05mol·L-1NaCl、NaI的混合溶液中滴加2滴0.01mol·L-1AgNO3溶液,振荡,沉淀是黄色 | Ksp(AgCl)<Ksp(AgI) |
D | 室温下,用pH试纸测得0.1mol·L-1 NaHSO3溶液的pH约为5 | HSO3-的电离程度大于其水解程度 |
A. A B. B C. C D. D