题目内容
在32 16S2-中,质子数为 ,中子数为 ,电子数为: ;画出该离子子的结构示意图 ,该元素在元素周期表中的位置是第 周期 族,该元素的最高价氧化物对应水化物的化学式是: .
【答案】分析:根据元素符号各方向上的数字代表的含义判断质子数、中子数,根据离子的核内质子数与电子数的关系分析电子数;根据核外电子排布书写离子结构示意图;根据其原子结构示意图判断所属的周期、族;
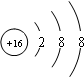
解答:解:3216S2-中左下角表示质子数,左上角表示质量数,中子数=质量数-质子数.所以其质子数为16,中子数为16,质量数为32;阴离子的核外电子数=质子数+所带电荷数,所以其电子数是18;其核外电子排布为2、8、8,所以其离子结构示意图为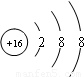 ;该元素的原子结构示意图为
;该元素的原子结构示意图为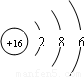 ,原子结构示意图中电子层数=周期数,最外层电子数=族序数,所以该元素是第三周期第VIA族;该元素的最高价氧化物为SO 3,SO3+H2O=H2SO4,
,原子结构示意图中电子层数=周期数,最外层电子数=族序数,所以该元素是第三周期第VIA族;该元素的最高价氧化物为SO 3,SO3+H2O=H2SO4,
所以其最高价氧化物的水化物化学式为H2SO4.
故答案为:16;16;18;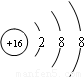 ;3;VIA;H2SO4.
;3;VIA;H2SO4.
点评:本题考查了质子数、中子数、质量数、电子数之间的相互关系,要注意在阴阳离子中质子数、电荷数、电子数的关系,这是易错之处,阴离子的电子数=质子数+电荷数,阳离子的电子数=质子数-电荷数.
解答:解:3216S2-中左下角表示质子数,左上角表示质量数,中子数=质量数-质子数.所以其质子数为16,中子数为16,质量数为32;阴离子的核外电子数=质子数+所带电荷数,所以其电子数是18;其核外电子排布为2、8、8,所以其离子结构示意图为
 ;该元素的原子结构示意图为
;该元素的原子结构示意图为 ,原子结构示意图中电子层数=周期数,最外层电子数=族序数,所以该元素是第三周期第VIA族;该元素的最高价氧化物为SO 3,SO3+H2O=H2SO4,
,原子结构示意图中电子层数=周期数,最外层电子数=族序数,所以该元素是第三周期第VIA族;该元素的最高价氧化物为SO 3,SO3+H2O=H2SO4,所以其最高价氧化物的水化物化学式为H2SO4.
故答案为:16;16;18;
 ;3;VIA;H2SO4.
;3;VIA;H2SO4.点评:本题考查了质子数、中子数、质量数、电子数之间的相互关系,要注意在阴阳离子中质子数、电荷数、电子数的关系,这是易错之处,阴离子的电子数=质子数+电荷数,阳离子的电子数=质子数-电荷数.

练习册系列答案
相关题目