题目内容
(18分)锡是一种银白色而又柔软的金属, 2000年前人类就已开始使用锡。金属锡为排列在白金,黄金及银后面的第四种贵金属,它富有光泽、无毒、不易氧化变色,具有很好的杀菌、净化、保鲜效用。生活中常用于食品保鲜、罐头内层的防腐膜等。请回答下列有关锡的问题:
(1)锡在自然界几乎都以锡石的形式存在,此外还有极少量的锡的硫化物矿。以锡石(SnO2)为原料,用足量的焦炭作还原剂,在高温下可制得粗锡,该反应的化学方程式为 ,粗锡经电解精炼可得纯锡,精炼时的阴极反应式为____________。
(2)锡的氯化物有SnCl2和SnCl4。SnCl2是生产和化学实验中常用的还原剂,易发生水解;SnCl4常温下是无色液体,在空气中极易水解,熔点—36℃,沸点114℃。
Ⅰ.若实验室中以SnCl2固体配制SnCl2溶液,试简述操作方法 。
Ⅱ.某实验小组拟利用下图中的仪器,设计组装一套实验装置,用熔融的金属锡与干燥的氯气直接作用制取无水四氯化锡(此反应过程放出大量的热),已知金属锡的熔点为231℃。请回答下列各问题:
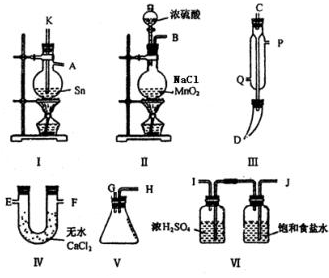
①用玻管(未画出)连接上述装置,正确的顺序是(填各接口的代码字母)____接____、____接____、____接____、____接____、____接____。
②装置Ⅵ的作用是___________;装置Ⅳ的作用是___________。
③冷凝管里冷却水的流向是从___________进入,从___________流出。
④试验时点燃Ⅰ处酒精灯,加热温度应大于 ℃,待 即可停止加热。
⑤如果将制取的四氯化锡少许暴露于空气中,预期可看到的现象是_______________。
⑥该实验装置中还存在的一个问题是 。
(1)锡在自然界几乎都以锡石的形式存在,此外还有极少量的锡的硫化物矿。以锡石(SnO2)为原料,用足量的焦炭作还原剂,在高温下可制得粗锡,该反应的化学方程式为 ,粗锡经电解精炼可得纯锡,精炼时的阴极反应式为____________。
(2)锡的氯化物有SnCl2和SnCl4。SnCl2是生产和化学实验中常用的还原剂,易发生水解;SnCl4常温下是无色液体,在空气中极易水解,熔点—36℃,沸点114℃。
Ⅰ.若实验室中以SnCl2固体配制SnCl2溶液,试简述操作方法 。
Ⅱ.某实验小组拟利用下图中的仪器,设计组装一套实验装置,用熔融的金属锡与干燥的氯气直接作用制取无水四氯化锡(此反应过程放出大量的热),已知金属锡的熔点为231℃。请回答下列各问题:

①用玻管(未画出)连接上述装置,正确的顺序是(填各接口的代码字母)____接____、____接____、____接____、____接____、____接____。
②装置Ⅵ的作用是___________;装置Ⅳ的作用是___________。
③冷凝管里冷却水的流向是从___________进入,从___________流出。
④试验时点燃Ⅰ处酒精灯,加热温度应大于 ℃,待 即可停止加热。
⑤如果将制取的四氯化锡少许暴露于空气中,预期可看到的现象是_______________。
⑥该实验装置中还存在的一个问题是 。
(1)SnO2+C Sn+CO Sn2++2e-="Sn"
Sn+CO Sn2++2e-="Sn"
(2)Ⅰ先将SnCl2固体溶解在少量浓盐酸中,再加水稀释,同时在新配制好的溶液中加少量金属Sn,以防止被氧化。
Ⅱ①B、J;I、K;A、C;D、G;H、E(或F)
②除去Cl2中的HCl和水气;防止空气中水蒸气进入收集SnCl4瓶内。
③Q;P
④231℃,锡粒熔化
⑤有白雾产生
⑥缺少最后的尾气吸收装置,应用盛有NaOH(或碱)溶液的烧杯吸收多余Cl2
 Sn+CO Sn2++2e-="Sn"
Sn+CO Sn2++2e-="Sn" (2)Ⅰ先将SnCl2固体溶解在少量浓盐酸中,再加水稀释,同时在新配制好的溶液中加少量金属Sn,以防止被氧化。
Ⅱ①B、J;I、K;A、C;D、G;H、E(或F)
②除去Cl2中的HCl和水气;防止空气中水蒸气进入收集SnCl4瓶内。
③Q;P
④231℃,锡粒熔化
⑤有白雾产生
⑥缺少最后的尾气吸收装置,应用盛有NaOH(或碱)溶液的烧杯吸收多余Cl2
本题插图应该是:

(1)焦炭与锡石在高温下发生氧化还原反应生成锡,炭被氧化为CO(高温下碳的低价氧化物稳定),即:SnO2+C Sn+CO
Sn+CO
金属的精炼时,纯锡做阴极,溶液中的锡离子得电子析出:Sn2++2e-="Sn"
(2)Ⅰ.综合题目所给信息,SnCl2易水解、易氧化,故应将SnCl2固体溶解在少量浓盐酸中,抑制其水解,加水稀释后,加金属锡,以防止其氧化:Sn4++Sn=2Sn2+
Ⅱ.①制取四氯化锡首先得制取干燥纯净的氯气,所需装置为II、VI,用饱和食盐水吸收HCl气体,用浓硫酸干燥,气流遵循“长进短出”,接口顺序为B、J;I
装置I为四氯化锡的制取装置,由于反应放大量的热,过量的氯气及气化的四氯化锡混合从运管A口逸出,随后需要冷凝管(装置III)进行冷却,经冷凝的四氯化锡液体收集要装置V中,接口顺序为I、K;A、C;D、G;H
为防止空气中的水蒸气进入装置V中(四氯化锡极易水解,保证其无水环境),H接口后应连接装置IV,其中的CaCl2可阻止空气的水分;
综合可知,接口顺序为B、J;I、K;A、C;D、G;H、E
②装置Ⅵ的作用是除去Cl2中的HCl和水气;装置Ⅳ的作用是防止空气中水蒸气进入收集SnCl4瓶内;
③为保证冷凝水的冷凝效果,应从低口Q进,高口P出,使热气遇到的一直是冷水
④加热温度只需超过金属锡的熔点为231℃即可,由于反应大量放热,待锡粒熔化后即可停止加热
⑤四氯化锡少许暴露于空气,与水水解,生成大量的极易溶于水的HCl气体,形成白雾
⑥由于氯气有毒,而本实验缺少尾气吸收装置,应用盛有NaOH(或碱)溶液的烧杯吸收多余Cl2

(1)焦炭与锡石在高温下发生氧化还原反应生成锡,炭被氧化为CO(高温下碳的低价氧化物稳定),即:SnO2+C
 Sn+CO
Sn+CO金属的精炼时,纯锡做阴极,溶液中的锡离子得电子析出:Sn2++2e-="Sn"
(2)Ⅰ.综合题目所给信息,SnCl2易水解、易氧化,故应将SnCl2固体溶解在少量浓盐酸中,抑制其水解,加水稀释后,加金属锡,以防止其氧化:Sn4++Sn=2Sn2+
Ⅱ.①制取四氯化锡首先得制取干燥纯净的氯气,所需装置为II、VI,用饱和食盐水吸收HCl气体,用浓硫酸干燥,气流遵循“长进短出”,接口顺序为B、J;I
装置I为四氯化锡的制取装置,由于反应放大量的热,过量的氯气及气化的四氯化锡混合从运管A口逸出,随后需要冷凝管(装置III)进行冷却,经冷凝的四氯化锡液体收集要装置V中,接口顺序为I、K;A、C;D、G;H
为防止空气中的水蒸气进入装置V中(四氯化锡极易水解,保证其无水环境),H接口后应连接装置IV,其中的CaCl2可阻止空气的水分;
综合可知,接口顺序为B、J;I、K;A、C;D、G;H、E
②装置Ⅵ的作用是除去Cl2中的HCl和水气;装置Ⅳ的作用是防止空气中水蒸气进入收集SnCl4瓶内;
③为保证冷凝水的冷凝效果,应从低口Q进,高口P出,使热气遇到的一直是冷水
④加热温度只需超过金属锡的熔点为231℃即可,由于反应大量放热,待锡粒熔化后即可停止加热
⑤四氯化锡少许暴露于空气,与水水解,生成大量的极易溶于水的HCl气体,形成白雾
⑥由于氯气有毒,而本实验缺少尾气吸收装置,应用盛有NaOH(或碱)溶液的烧杯吸收多余Cl2

练习册系列答案
相关题目

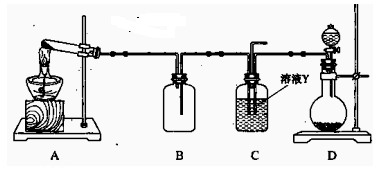

 不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是 。
不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是 。