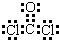题目内容
下列物质不能由单质之间的化合反应得到的是
- A.NO
- B.NO2
- C.FeCl2
- D.CuCl 2
BC
解析:
N2、O2在放电条件下发生化合反应得到的是NO,而不是NO2,故A正确,B错误;Fe在Cl2中燃烧应生成FeCl3,而不是FeCl2,故C错误
解析:
N2、O2在放电条件下发生化合反应得到的是NO,而不是NO2,故A正确,B错误;Fe在Cl2中燃烧应生成FeCl3,而不是FeCl2,故C错误

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
X、Y、Z、M、R、W为六种短周期元素,原子序数依次递增.Y、Z、M是同周期元素,且Z、M最外层电子数之差为1.X+无电子,-ZX是有机物中常见官能团.Y是组成化合物最多的元素,组成为RZX的物质能溶解W2Z3型物质.下列说法不正确的是( )
| A、由X与Y组成的化合物的沸点可能高于由X与Z组成的化合物的沸点 | B、X、Z、R三种元素中的任意两种组合成的(1:1型)物质中均含有共价键 | C、常压条件下,沸点:X2Z2>XM;简单离子半径:Z>M>R>W | D、R3WM6晶体可作为工业电解熔融W2Y3制W单质时的助熔剂 |
有关元素X、Y、Z、D、E的信息如下:
请回答下列问题(用化学用语表示):
(1)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为 .
(2)比较Y与Z的氢化物的稳定性>(用化学式表示) .
(3)E元素与Y元素可形成EY2和EY3,两种化合物,则下列说法中正确的是 (填序号)
①通常实验室配制EY2溶液时,可直接用水溶解EY3固体
②EY2不能通过单质直接化合产生
③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
④Y、Z、D的离子半径大小依次减小
(4)Y的最高价氧化物为无色液体,当0.25mol该物质与一定量的水混合得到一种稀溶液时,放出QkJ的热量.写出该反应的热化学方程式 .
(5)写出E在潮湿的空气中发生腐蚀时正极上的电极反应式 .
(6)氯碱工业上制取气体Y单质的反应时,当电路中通过amol电子时,阴阳两极共产生气体 L(标准状况).
| 元素 | 有关信息 |
| X | 元素主要化合价-2,原子半径为0.0074nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 单质在X的单质中燃烧,产物是造成酸雨的罪魁祸首之一 |
| D | 最高价氧化物对应的水化物能电离出电子数相等的阴、阳离子 |
| E | 单质是生活中的常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
(1)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为 .
(2)比较Y与Z的氢化物的稳定性>(用化学式表示) .
(3)E元素与Y元素可形成EY2和EY3,两种化合物,则下列说法中正确的是 (填序号)
①通常实验室配制EY2溶液时,可直接用水溶解EY3固体
②EY2不能通过单质直接化合产生
③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
④Y、Z、D的离子半径大小依次减小
(4)Y的最高价氧化物为无色液体,当0.25mol该物质与一定量的水混合得到一种稀溶液时,放出QkJ的热量.写出该反应的热化学方程式 .
(5)写出E在潮湿的空气中发生腐蚀时正极上的电极反应式 .
(6)氯碱工业上制取气体Y单质的反应时,当电路中通过amol电子时,阴阳两极共产生气体 L(标准状况).
有关元素X、Y、Z、D、E的信息如下:
| 元素 | 有关信息 |
| X | 元素主要化合价-2,原子半径为0.0074nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 单质在X的单质中燃烧,产物是造成酸雨的罪魁祸首之一 |
| D | 最高价氧化物对应的水化物能电离出电子数相等的阴、阳离子 |
| E | 单质是生活中的常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
请回答下列问题(用化学用语表示):
(1)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为
。
(2)比较Y与Z的氢化物的稳定性 > (用化学式表示)。
(3)E元素与Y元素可形成EY2和EY3,两种化合物,则下列说法中正确的是 (填序号)
①通常实验室配制EY2溶液时,可直接用水溶解EY3固体
②EY2不能通过单质直接化合产生
③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
④Y、Z、D的离子半径大小依次减小
(4)Y的最高价氧化物为无色液体,当0.25mol该物质与一定量的水混合得到一种稀溶液时,放出![]() 的热量。写出该反应的热化学方程式 。
的热量。写出该反应的热化学方程式 。
(5)写出E在潮湿的空气中发生腐蚀时正极上的电极反应式 。
(6)氯碱工业上制取气体Y单质的反应时,当电路中通过![]() 电子时,阴阳两极共产生气体 L(标准状况)。
电子时,阴阳两极共产生气体 L(标准状况)。
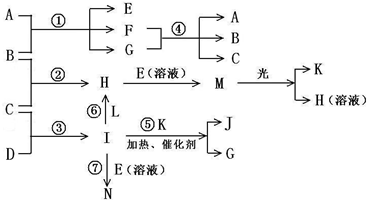
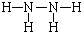
 的电子式
的电子式