题目内容
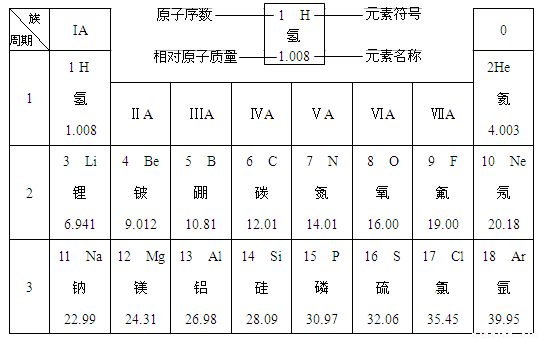
下图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题
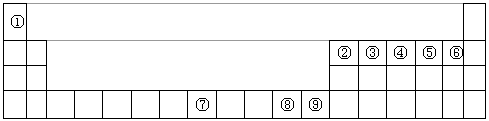
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,①元素位于周期表的________区。
(2)②、⑥两元素形成的化合物的空间构型为________,其中心原子的杂化轨道类型为________。
(3)写出元素⑧基态原子的电子排布式________________。
(4)⑧的二价阳离子与过量的④的氢化物的水化物作用的离子方程式为:________________________。
(5)元素⑦与CO可形成的X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为
103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于________晶体(填晶体类型)。
(6)元素⑨的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为________。
(7)金属⑦的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为________。
(2)②、⑥两元素形成的化合物的空间构型为________,其中心原子的杂化轨道类型为________。
(3)写出元素⑧基态原子的电子排布式________________。
(4)⑧的二价阳离子与过量的④的氢化物的水化物作用的离子方程式为:________________________。
(5)元素⑦与CO可形成的X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为
103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于________晶体(填晶体类型)。
(6)元素⑨的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为________。
(7)金属⑦的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为________。

(1)s
(2)平面正三角形;sp2杂化
(3)1s22s22p63s23p63d104s1或 [Ar] 3d104s1
(4)Cu2++4NH3=[Cu(NH3)4]2+
(5)分子晶体
(6)配位键
(7)2:1
(2)平面正三角形;sp2杂化
(3)1s22s22p63s23p63d104s1或 [Ar] 3d104s1
(4)Cu2++4NH3=[Cu(NH3)4]2+
(5)分子晶体
(6)配位键
(7)2:1

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目