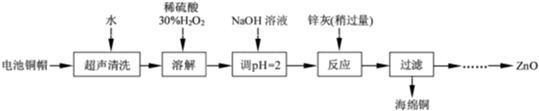
题目内容
| A.4Fe(OH)2+2H2O+O2===4Fe(OH)3↓ |
| B.2Fe+2H2O+O2===2Fe(OH)2↓ |
| C.2H2O+O2+4e-===4OH- |
| D.Fe-3e-===Fe3+ |
D
洗过的铁锅在空气中放置,可发生吸氧腐蚀。负极发生的反应为2Fe-4e-==2Fe2+,正极发生的反应为2H2O+O2+4e-===4OH-,总反应式为2Fe+2H2O+O2===2Fe(OH)2,而Fe(OH)2又被O2氧化为红褐色的Fe(OH)3。

练习册系列答案
相关题目