题目内容
16.4g NaOH和NaHCO3的固体混合物投入150ml 2.0mol?L-1的盐酸中恰好完全反应,不再产生气泡,则所得溶液中溶质的物质的量为多少( )
分析:发生反应NaHCO3+HCl=NaCl+H2O+CO2↑、NaCl+HCl=NaCl+H2O,由于恰好反应,反应后溶液中溶质为NaCl,根据氯离子守恒可知n(NaCl)=n(HCl).
解答:解:NaOH和NaHCO3的固体混合物投入盐酸中发生反应NaHCO3+HCl=NaCl+H2O+CO2↑、NaCl+HCl=NaCl+H2O,由于恰好反应,反应后溶液中溶质为NaCl,根据氯离子守恒可知n(NaCl)=n(HCl)=0.15L×2.0mol?L-1=0.3mol.
故选C.
故选C.
点评:考查混合物的计算等,难度不大,判断溶液中溶质是解题的关键,可以列方程组计算,注意守恒思想在计算中的运用.

练习册系列答案
相关题目
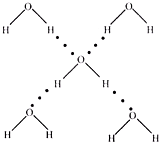 NA代表阿伏伽德罗常数值,下列说法正确的是( )
NA代表阿伏伽德罗常数值,下列说法正确的是( )