题目内容
某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-和ClO3-的浓度之比为1:3,则Cl2与NaOH反应时,被还原的氯元素与被氧化的氯元素物质的量之比为 ( )
![]() A.21:5 B.11:3 C.3:1 D.4:1
A.21:5 B.11:3 C.3:1 D.4:1
D
解析:
Cl2与NaOH溶液反应,Cl2既是氧化剂又是还原剂,从电子得失角度分析,被氧化的Cl分别从0→+1、0→+5,根据题目所给条件分析得ClO-和ClO3-的个数之比为1:3,则被氧化的一方4个0价Cl共失电子1+3×5=16;被还原Cl从0→-1,欲使得失电子总数相等,则需16个0价Cl。所以,被还原的氯元素与被氧化的氯元素的物质的量之比为16:4=4:1。

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目



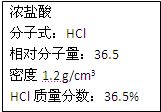 右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: