题目内容
(14分)甲醇的用途广泛,摩托罗拉公司也开发出一种由甲醇、氧气以及强碱做电解质溶液的新型手机电池,容量达氢镍电池或锂电池的10倍,可连续使用一个月才充一次电.请完成下列与甲醇有关的问题.
(1)工业上用3克氢气与二氧化碳反应生成气态甲醇和水蒸气,放出24.5千焦的热量。
①请写出该反应的热化学反应方程式:
利用该反应,在温度和容积相同的A、B两个容器中,按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
②从反应开始到达到平衡时,A中用CO2来表示的平均反应速率为 。
③A中达到平衡时CO2的转化率为 , a= 。
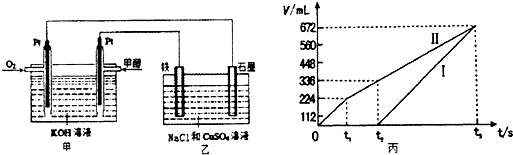
(2)某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如题1图:
①写出甲中通入甲醇这一极的电极反应式 。
②理论上乙中两极所得气体的体积随时间变化的关系如题2图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式 ;在t2时所得溶液的pH约为 。
(14分 每空2分)
(1)①
② 0.1c1 mol/(L·S) 或0.1c2 mol/(L·S)(任答对一个得分) ③ 60% 19.6
(2)① CH3OH- 6e-+ 8OH- = CO32-+ 6H2O ② 4OH- - 4e- = O2↑+ 2H2O 1
解析:(1)考查热化学方程式的书写和反应热的有关计算。A容器中放出29.4kJ热量,所以消耗的氢气是![]() ,物质的量是1.8mol,消耗二氧化碳的物质的量是0.6mol,故平衡时CO2的转化率为60%。因为化学反应速率之比是化学计量数之比,所以A中用CO2来表示的平均反应速率为0.1c1 mol/(L··S)。因为平衡的建立与途径无关,所以B容器与A是等效的,所以平衡时B中应该生成0.4mol二氧化碳,所以反应吸收的热量是0.4×49=19.6kJ。
,物质的量是1.8mol,消耗二氧化碳的物质的量是0.6mol,故平衡时CO2的转化率为60%。因为化学反应速率之比是化学计量数之比,所以A中用CO2来表示的平均反应速率为0.1c1 mol/(L··S)。因为平衡的建立与途径无关,所以B容器与A是等效的,所以平衡时B中应该生成0.4mol二氧化碳,所以反应吸收的热量是0.4×49=19.6kJ。
(2)在反应中甲醇失去电子,其负极的电极反应式为CH3OH -6e-+ 8OH-=CO32-+ 6H2O。电解NaCl与CuSO4混合溶液时,阳极Cl-失去电子生成氯气,阴极Cu2+得到电子,当二者电解完毕之后,阳极OH-失去电子生成氧气,阴极H+得到电子得到氢气。根据图像可知I代表氢气,Ⅱ代表氯气和氧气。t1后开始生成氧气,电极反应式为4OH- -4e- =O2↑+ 2H2O。t2时生成氧气的体积是336-224=112ml,所以消耗的OH-的量是0.005mol×4=0.02mol,因此溶液中生成的氢离子的量是0.02mol,其浓度为0.1mol·L-1,故pH为1.

 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案