题目内容
(16分)化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
I、摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水搅拌、过滤。并进行如下实验
(1)、请完成表格中的填空:
| 实验步骤 | 实现现象 | 反应的离子方程式 |
| 往滤渣中加入过量NaOH溶液。 |
| ① |
| 过滤,往所得滤液中通入过量二氧化碳, | ② | ③ |
| 继续加入过量稀盐酸 | ④ |
|
II、牙膏样品中碳酸钙的定量测定
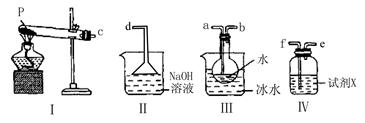
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
依据实验过程回答下列问题:
(2)、实验过程中先后两次鼓入空气,第二次鼓入空气的目的是:
。
(3)、C中反应生成BaCO3的化学方程式是 。
(4)、下列各项措施中,不能提高测定准确度的是 (填标号)。
A.在加入盐酸之前,应排净装置内的CO2气体
B.滴加盐酸不宜过快
C.在A—B之间增添盛有浓硫酸的洗气装置
D.在B—C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(5)、实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g.则样品中碳酸钙的质量分数为 。
(6)、某同学提出将C中的Ba(OH)2换成浓H2SO4 ,通过测定D装置反应前后的质量差也可以测定CaCO3的含量,假设反应前D装置的质量为m1,实验结束后D装置的质量为m2,则样品中CaCO3的质量为 。实验证明按此测定的结果偏高,原因是 。
(16分)(1)、①Al(OH)3+OH―=AlO2―+2H2O (1分);
②有白色沉淀产生(1分)
③AlO2―+CO2+2H2O=Al(OH)3↓+HCO3― (1分);④沉淀溶解,有气体产生(1分)
(2)、驱赶残留在装置中的CO2以使生成的CO2完全被吸收 (2分)
(3)、CO2+Ba(OH)2 =BaCO3↓+H2O (2分)
(4)、CD (2分)
(5)、0.25(25%)(2分)
(6)、(2分) D装置吸收反应生成的CO2外,还会吸收挥发出的HCl,同时空气中的H2O和CO2 也会进入D装置。使m2-m1偏大(2分)。
解析:略

 l2有无漂白性。
l2有无漂白性。
 。
。 红色布条的现象可得出的结论是
红色布条的现象可得出的结论是 

