题目内容
8.已知:①1mol H2分子中化学键断裂时需要吸收436kJ的能量,②1mol I2蒸气中化学键断裂时需要吸收151kJ的能量,③由H原子和I原子形成1mol HI分子时释放299kJ的能量.下列判断不正确的是( )| A. | I2蒸气比H2分子稳定 | |
| B. | 2 mol HI(g)发生分解反应吸收11 kJ热量 | |
| C. | HI与NaOH反应属于放热反应 | |
| D. | 0.5 mol H2(g)与0.5 mol I2(g)完全反应释放出5.5 kJ 热量 |
分析 A.化学键的键能越大,分子中的化学键更牢固;
B.根据焓变=反应物键能之和-生成物键能之和;
C.HI与NaOH反应属于中和反应;
D.焓变与反应物的系数成正比;
解答 解:A.断裂1mol H2分子中的化学键需吸收能量436kJ,断裂1mol I2蒸气中化学键时需要吸收151kJ的能量,所以相同条件下,H2分子中的化学键更牢固,则H2比I2稳定,故A错误;
B.反应:H2+I2=2HI生成2molHI,需要吸收能量断裂旧的化学键1molH-H键和1molI-I键,形成新的化学键释放能量.所以该反应的反应热为△H=436kJ+151kJ-2×299kJ=-11kJ/mol<0,所以2 mol HI(g)发生分解反应吸收11 kJ热量,故B正确;
C.HI与NaOH反应属于中和反应,所以为放热反应,故C正确;
D.由B分析可知,H2+I2=2HI生成2molHI放出11 kJ热量,所以0.5 mol H2(g)与0.5 mol I2(g)完全反应释放出5.5 kJ 热量,故D正确;
故选A.
点评 该题主要考查了反应热与△H间、化学键与分子的稳定性、反应热与化学计量数间的关系,解题时需正确辨析它们间的联系与区别.

练习册系列答案
相关题目
18.下列关于氧化性、还原性的判断正确的是( )
| A. | B的阳离子的氧化性比A的阳离子强,说明A元素的金属性一定比B元素强 | |
| B. | 发生氧化还原反应时,A原子失去的电子比B原子多,证明A的金属性一定比B强 | |
| C. | 适量的Cl2通入FeI2溶液中可发生反应:3Cl2+6FeI2=2FeCl3+4FeI3 | |
| D. | 一定量氯气通入30 mL 10.00 mol•L-1的氢氧化钠溶液中,加热后形成NaCl、NaClO、NaClO3共存的溶液,若反应中转移的电子为n mol,则0.15<n<0.25 |
19.下列关于葡萄糖(C6H12O6)和维生素C(C6H8O6)的说法中正确的是( )
| A. | 葡萄糖和维生素C中含有的碳、氧原子个数相等 | |
| B. | 葡萄糖和维生素C中碳元素和氧元素的质量比都是l:1 | |
| C. | -个葡萄糖分子比-个维生素C分子多4个氢原子 | |
| D. | -个维生素C分子中的中子数和电子数一定相等 |
16.铷和另一种碱金属的合金46g,与水完全反应,放出2g的氢气,则合金中另一种金属是( )
| A. | Li | B. | Na | C. | K | D. | Cs |
3.下列说法正确的是( )
| A. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 | |
| B. | CH3-CH=CH-CH3与C3H6一定互为同系物 | |
| C. | 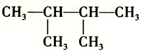 的名称是2,3-甲基丁烷 的名称是2,3-甲基丁烷 | |
| D. | 乙醇可与水以任意比例混溶,是因为与水形成了氢键 |
13.我国稀土资源丰富.中国改革开放的总设计师邓小平同志曾经意味深长地说:“中东有石油,我们有稀土.”下列有关稀土元素${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm的说法正确的是( )
| A. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm的质量数相同 | |
| B. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm互为同素异形体 | |
| C. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm是同一种核素 | |
| D. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm的核外电子数和质子数均为62 |
20.下列有关物质结构的表述正确的是( )
| A. | H2O2的电子式: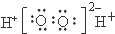 | B. | CS2的比例模型: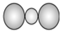 | ||
| C. | 14C的原子结构示意图: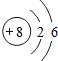 | D. | CCl4的结构式: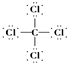 |
18.既可以用来鉴别乙烷和乙烯,又可以除去乙烷中混有的乙烯的方法是( )
| A. | 通过溴的CCl4溶液中洗气 | B. | 通过酸性KMnO4溶液中洗气 | ||
| C. | 通过溴的水溶液中洗气 | D. | 在Ni催化下,通入H2 |