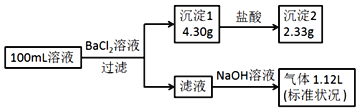
题目内容
【题目】甲、乙两只烧杯中各盛有100 Ml 2.5 mol·L-1的盐酸和NaOH溶液,向两只烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体的体积比为V(甲):V(乙)=5:6,则加入铝粉的质量为
A. 10.8g B. 3.6g C. 5.4g D. 2.7g
【答案】D
【解析】
铝的质量相同,盐酸和氢氧化钠溶液中溶质的物质的量相同,若Al都完全反应,则生成氢气应相等,反应结束后测得生成的气体的体积比为V(甲):V(乙)=5:6,由化学方程式:2Al+6HCl═2AlCl3+3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑,其化学计量数之比等于参加反应的各物质的物质的量之比。可以看出,酸与碱分别与相同物质的量的Al反应时,HCl消耗较多,则可推知上述条件下,酸与金属反应时酸少量,碱与金属反应时碱过量,结合方程式分析解答。
盐酸和氢氧化钠溶液中溶质的物质的量均为0.1 L×2.5 mol/L=0.25 mol,
设铝与酸反应时酸完全反应,生成的氢气的物质的量为x,则:
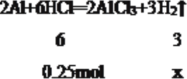
解得x=0.25 mol×![]() = 0.125 mol,
= 0.125 mol,
则根据V(甲):V(乙)=5:6可知,碱与金属铝反应生成的氢气的物质的量为0.125 mol×![]() = 0.15 mol,
= 0.15 mol,
碱与金属铝反应时铝完全反应,设与碱反应的铝的物质的量为y,则:

解得y=0.15mol×![]() = 0.1 mol
= 0.1 mol
则铝的质量为0.1 mol×27 g/mol = 2.7 g,
答案选D。

【题目】在恒温、恒容条件下发生下列反应:2X2O5 (g) ![]() 4XO2(g) +O2(g) △H>0,T温度下的部分实验数据为:
4XO2(g) +O2(g) △H>0,T温度下的部分实验数据为:
t/s | 0 | 50 | 100 | 150 |
c(X2O5) mol/L | 4.00 | 2.50 | 2.00 | 2.00 |
下列说法错误的是
A. T温度下的平衡数为K=64 (mol/L)3,100s时转化率为50%
B. 50s 内 X2O5分解速率为 0.03 mol/ (Ls)
C. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则Kl>K2
D. 若只将恒容改为恒压,其它条件都不变,则平衡时X2O5的转化率和平衡常数都不变