题目内容
( 12分)钛(Ti)被称为继铁、铝之后的第三金属,钝钛和以钛为主的合金是新型的结构材料,主要用于航天工业和航海工业,下列是有关钛的冶炼及应用的问题。
(1)金属钛冶炼过程中其中一步反应是将原料金红石转化:TiO2(金红石)+2C+2Cl2 TiCl4+2CO
已知:C(S)+O2(g)=CO2(g) ![]() H=-393.5 kJ·mol-1
H=-393.5 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ![]() H=-566 kJ·mol-1
H=-566 kJ·mol-1
TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ![]() H=+141 kJ·mol-1
H=+141 kJ·mol-1
则TiO2(g)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的![]() H= ,
H= ,
(2)钠热还原法是冶炼金属钛的方法之一,主要反应原理为:4Na+TiCl4 4NaCl+Ti,该反应不能在水溶液中进行,一是因为TiCl4会强烈水解生成TiO2,另一原因 (用适当化学方程式辅以必要的文字说明)。
(3)镁还原法也是冶炼金属钛的常用方法,其主要反应原理如下:
MgCl2 Mg+Cl2 TiCl4+2Mg
2MgCl2+Ti
从海水中提取MgCl2时,先在海水中加入熟石灰,沉淀出Mg(OH)2,写出Mg(OH)2溶度积表达式:
可加入适当过量的熟石灰,从Mg(OH)2溶解平衡角度解释其原因
(4)TiCl4与LiOH在水溶液中一定条件下可反应生成Li4Ti5O12(钛酸锂),Li4Ti5O12可与LiMn2O4(锰酸锂)等正极材料组成理离子二次电池,工作时Li+ 在电池内定向移动,其电池反应为:,使用时先充电,写出其充电式的阳极反应 ,放电时Li+的移动方向 。
( 12分,每空2分)(1)-80kJ/mol
(2)2Na+2H2O=2NaOH+H2↑,金属钠与水剧烈反应,不会置换出钛
(3)![]() ;氢氧根离子浓度增大,使氢氧化镁的溶解平衡左移,有利于氢氧化镁的析出
;氢氧根离子浓度增大,使氢氧化镁的溶解平衡左移,有利于氢氧化镁的析出
(4)3LiMn2O4-3e-=3Li++ 6MnO2 从负极(Li7Ti5O12) 移向正极(MnO2)
解析:(1)考查盖斯定律的应用。设已知的3个反应依次为①②③,则①×2-②+③即得到TiO2(g)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g),所以其反应热![]() H=(-393.5×2+566+141)kJ·mol-1=-80.0 kJ·mol-1。
H=(-393.5×2+566+141)kJ·mol-1=-80.0 kJ·mol-1。
(2)钠属于活泼性金属,极易和水反应生成氢气,方程式为2Na+2H2O=2NaOH+H2↑。
(3)在一定条件下,当沉淀溶解达到平衡时生成物浓度的幂之积即为溶度积常数,所以Mg(OH)2溶度积表达式![]() 。加入适当过量的熟石灰后,增大量溶液中的氢氧根离子浓度,使溶解平衡向逆反应方向移动,从而有沉淀析出。
。加入适当过量的熟石灰后,增大量溶液中的氢氧根离子浓度,使溶解平衡向逆反应方向移动,从而有沉淀析出。
(4) 充电时阳极失去电子,根据总反应式可看出锰的化合价升高,所以阳极的电极反应式为3LiMn2O4-3e-=3Li++ 6MnO2。放电相当于原电池,阳离子向正极移动。

 阅读快车系列答案
阅读快车系列答案 TiCl4+2CO
TiCl4+2CO H=-393.5 kJ·mol-1
H=-393.5 kJ·mol-1 4NaCl+Ti,该反应不能在水溶液中进行,一是因为TiCl4会强烈水解生成TiO2,另一原因 (用适当化学方程式辅以必要的文字说明)。
4NaCl+Ti,该反应不能在水溶液中进行,一是因为TiCl4会强烈水解生成TiO2,另一原因 (用适当化学方程式辅以必要的文字说明)。 Mg+Cl2 TiCl4+2Mg
Mg+Cl2 TiCl4+2Mg 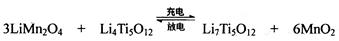 ,使用时先充电,写出其充电式的阳极反应 ,放电时Li+的移动方向 。
,使用时先充电,写出其充电式的阳极反应 ,放电时Li+的移动方向 。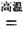 TiCl4+2CO
TiCl4+2CO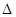 H=-393.5 kJ·mol-1
H=-393.5 kJ·mol-1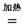 4NaCl+Ti,该反应不能在水溶液中进行,一是因为TiCl4会强烈水解生成TiO2,另一原因
(用适当化学方程式辅以必要的文字说明)。
4NaCl+Ti,该反应不能在水溶液中进行,一是因为TiCl4会强烈水解生成TiO2,另一原因
(用适当化学方程式辅以必要的文字说明)。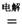 Mg+Cl2
TiCl4+2Mg
Mg+Cl2
TiCl4+2Mg 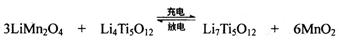 ,使用时先充电,写出其充电式的阳极反应 ,放电时Li+的移动方向
。
,使用时先充电,写出其充电式的阳极反应 ,放电时Li+的移动方向
。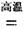 TiCl4+2CO
TiCl4+2CO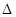 H=-393.5 kJ·mol-1
H=-393.5 kJ·mol-1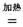 4NaCl+Ti,该反应不能在水溶液中进行,一是因为TiCl4会强烈水解生成TiO2,另一原因
(用适当化学方程式辅以必要的文字说明)。
4NaCl+Ti,该反应不能在水溶液中进行,一是因为TiCl4会强烈水解生成TiO2,另一原因
(用适当化学方程式辅以必要的文字说明)。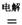 Mg+Cl2
TiCl4+2Mg
Mg+Cl2
TiCl4+2Mg 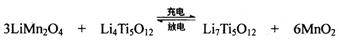 ,使用时先充电,写出其充电式的阳极反应 ,放电时Li+的移动方向
。
,使用时先充电,写出其充电式的阳极反应 ,放电时Li+的移动方向
。