题目内容
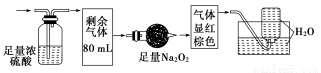
将一定量的锌与100mL18.5mol/L浓硫酸充分反应,锌完全溶解,同时生成16.8L气体 (标准状况),将反应后的溶液稀释到1L,测得溶液的c(H+)=1mol/L,则下列叙述中错误的是
A.气体A为二氧化硫和氢气的混合物
B.气体A中二氧化硫和氢气的体积比为4:1
C.反应中共消耗锌95.5g
D.反应中共转移电子1.5mol
C
【解析】
试题分析:由题意知原溶液n(H2SO4)=1.85mol,产生n(气体)=16.8L/22.4L/mol=0.75mol,剩余n(H+)=1mol。无论气体A是否为二氧化硫和氢气的混合物,都是得到2个电子的产物,所以反应中共转移0.75mol×2=1.5mol,D正确;根据得失电子守恒,反应过程中只有Zn失电子,所以Zn的物质的量为0.75mol,其质量为48.75g,C错误;反应后的溶液为ZnSO4和H2SO4的混合液,根据元素守恒,得被还原的SO42-为1.85-0.75-0.5=0.6mol,即产生二氧化硫的物质的量为0.6mol,则气体中必有氢气,其物质的量为0.75mol-0.6mol=0.15mol,它们的体积比也为物质的量比为4:1,AB正确,答案选C。
考点:考查锌与浓硫酸反应气体产物的分析计算,元素守恒、得失电子守恒规律的应用

就有关物质的分离回答下列问题:
(1)现有一瓶A和B的混合液,已知它们的性质如下表。
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
B | 17.9 | 290 | 1.26 |
据此分析,将A和B相互分离的常用方法是: 。
(2)在分液漏斗中用一种有机溶剂提取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法: 。