题目内容
在50mL a mol·L-1的硝酸溶液中,加入6.4g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100mL时测得c(NO3-)="3" mol·L-1。
(1)求稀释后的溶液的pH 。
(2)若生成的气体中NO2的物质的量为0.125 mol,则a=
(3)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO2+NO+2NaOH→2NaNO2+H2O 2NO2+2NaOH→NaNO2+NaNO3+H2O
若将上述的NO2和NO的混合气体通入2mol·L-1的NaOH恰好被吸收,求NaOH溶液的体积为 mL。生成的NaNO2为 mol。
(4)治理氮氧化物污染的另一种方法,可用氨氧混合气进行选择性催化还原处理。其主要反应原理如下:
4NO + 4NH3 + O2 4N2 + 6H2O 6NO2 + 8NH3
4N2 + 6H2O 6NO2 + 8NH3 7N2 + 12H2O
7N2 + 12H2O
某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已折算至标准状况),其中NO与NO2物质的量比为4∶1。设尾气中氮氧化物与氨氧混合气恰好完全反应。
①氨氧混合气的平均相对分子质量为 (精确到0.01)。
②要处理5m3的尾气,需要氨氧混合气的体积为 L。
(1)求稀释后的溶液的pH 。
(2)若生成的气体中NO2的物质的量为0.125 mol,则a=
(3)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO2+NO+2NaOH→2NaNO2+H2O 2NO2+2NaOH→NaNO2+NaNO3+H2O
若将上述的NO2和NO的混合气体通入2mol·L-1的NaOH恰好被吸收,求NaOH溶液的体积为 mL。生成的NaNO2为 mol。
(4)治理氮氧化物污染的另一种方法,可用氨氧混合气进行选择性催化还原处理。其主要反应原理如下:
4NO + 4NH3 + O2
 4N2 + 6H2O 6NO2 + 8NH3
4N2 + 6H2O 6NO2 + 8NH3 7N2 + 12H2O
7N2 + 12H2O某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已折算至标准状况),其中NO与NO2物质的量比为4∶1。设尾气中氮氧化物与氨氧混合气恰好完全反应。
①氨氧混合气的平均相对分子质量为 (精确到0.01)。
②要处理5m3的尾气,需要氨氧混合气的体积为 L。
(1)0 (2分)
(2)a= 9 (2分)
(3)75 mL(2分) 0.1 mol(2分)
(4)①___19.37 _(精确到0.01)。(3分) ②10.64L。(3分)
(2)a= 9 (2分)
(3)75 mL(2分) 0.1 mol(2分)
(4)①___19.37 _(精确到0.01)。(3分) ②10.64L。(3分)
试题分析:(1)6.4g Cu的物质的量为6.4/64=0.1mol,所以溶液n(Cu2+)=n(Cu)=0.1mol,溶液中c(NO3-)=c(H+)+2c(Cu2+),所以溶液中c(H+)=2c(Cu2+)-c(NO3-)=0.1/0.05×2-3mol/L=1mol/L,所以入PH=-lg1=0,故答案为:0.
(2)根据N元素守恒,可知n(NO2)+n(NO)=n硝酸溶液(HNO3)-n反应后溶液(NO3-)=0.05amol-0.1L×3mol/L=0.125mol+n(NO),根据电子守恒0.1×2=0.125+3n(NO);n(NO)="0.025mol;" a=9。
(3)反应后为NaNO2、NaNO3混合溶液,根据N元素守恒可知,n(NaNO2)+n(NaNO3)=n(NO2)+n(NO)=0.15mol,根据钠元素守恒可知,n(NaOH)=n(NaNO2)+n(NaNO3)=0.15mol,NaOH溶液的体积为.15mol/2mol/L=0.075L=75mL。因为n(NO2)=0.125mol,n(NO)=0.025mol,按方程式(1)反应后剩余n(NO2)-(NO)=0.125mol-0.025mol=0.1mol,生成NaNO20.05mol,则剩余的二氧化氮发生了第(2)个反应,生成NaNO2和NaNO3分别为0.05mol,两步反应中共生成NaNO2就为0.1mol。
(4)①设1m3尾气中NO2的物质的量为x,则NO的物质的量为4x,4xmol×30g/mol+46xg=2.49g,x=0.015mol,所以1m3尾气中NO2的物质的量为0.015mol,则NO的物质的量为0.06mol,根据4NO+4NH3+O2=4N2+6H2O 知,0.06molNO需要0.06molNH3,0.015molO2,根据方程式 6NO2+8NH3=7N2+12H2O知,0.015molNO2需要0.02molNH3,所以氨氧混合气体的平均摩尔质量
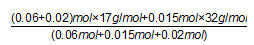 =19.37g/mol,所以其相对分子质量为19.37,故答案为:19.37;②处理1m3尾气需要氨氧混合物的体积:
=19.37g/mol,所以其相对分子质量为19.37,故答案为:19.37;②处理1m3尾气需要氨氧混合物的体积:(0.06+0.02+0.015)mol×22.4L/mol=2.128L,则要处理5m3的尾气,需要氨氧混合气的体积为=2.128L×5=10.64L,故答案为:10.64L;

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
 中含有的氧原子数是2×6.02×1023
中含有的氧原子数是2×6.02×1023