题目内容
【题目】汽车安全气囊弹出时的反应为:10NaN3+2KNO3+6SiO2![]() 5Na2SiO3+K2SiO3+16N2↑。下列说法正确的是
5Na2SiO3+K2SiO3+16N2↑。下列说法正确的是
A. 自然界中氮、钠、硅元素均可以游离态形式存在
B. 将反应后的固体溶于适量水,静置,通入CO2,无现象
C. 微粒的半径:r(K+)>r(Na+)>r(O2-)
D. 若反应中转移6.02×1022电子,则消耗NaN3的质量为6.5g
【答案】D
【解析】A、钠是活泼金属,在自然界中以化合态的形式存在,Si在自然界中以化合态的形式存在,故A错误;B、碳酸的酸性强于硅酸,反应是SiO32-+CO2+2H2O=H2SiO3↓+HCO3-,有白色沉淀产生,故B错误;C、电子层数越多,半径越大,K+核外有3个电子层,Na+和O2-核外有2个电子层,电子层数相等,半径随着原子序数的递增而减小,即O2-的半径大于Na+,因此有r(K+)>r(O2-)>r(Na+),故C错误;D、消耗10molNaN3转移电子物质的量为10mol,因此转移0.1mol电子,消耗NaN3的物质的量为0.1mol,即质量为6.5g,故D正确。

 名师指导一卷通系列答案
名师指导一卷通系列答案【题目】短周期元素A、B、C、D、E原子序数依次增大。A是周期表中原子半径最小的元素,B原子的价电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为_______________。
(2)已知:①E-E→2E·;△H=+a kJ·mol-1
② 2A·→A-A;△H=-b kJ·mol-1
③E·+A·→A-E;△H=-c kJ·mol-1(“·”表示形成共价键所提供的电子)
写出298K时,A2与E2反应的热化学方程式____________________________________。
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g)![]() X(g);△H=-dJ·mol-1(d>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
X(g);△H=-dJ·mol-1(d>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
实验 | 甲 | 乙 | 丙 |
初始投料 | 2 molA2、1 molBC | 1 molX | 4 molA2、2 molBC |
平衡时n(X) | 0.5mol | n2 | n3 |
反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
体系的压强 | P1 | P2 | P3 |
反应物的转化率 | α1 | α2 | α3 |
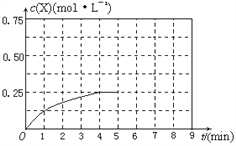
①在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则该时间段内A2的平均反应速率v(A2)________。
②该温度下此反应的平衡常数K的值为___________。
③三个容器中的反应分别达平衡时各组数据关系正确的是_______(填序号)。
A.α1+α2=1 B.Q1+Q2=d C.α3<α1
D.P3<2P1=2P2 E.n2<n3<1.0mol F.Q3=2Q1
④在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为65.5%,请在下图中画出第5min 到新平衡时X的物质的量浓度的变化曲线。_______