题目内容
脱硫技术能有效控制SO2对空气的污染.
(1)向煤中加入石灰石可减少燃烧产物中SO2的含量,该反应的化学方程式是______.
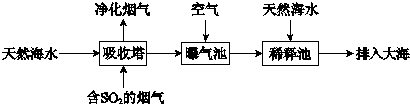
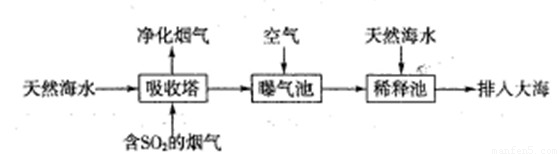
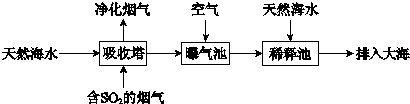
(2)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、HCO3-等离子.含SO2的烟气可利用海水脱硫,其工艺流程如下图所示:

①向曝气池中通入空气的目的是______.
②通入空气后曝气池中海水与天然海水相比,浓度有明显不同的离子是______.
a.Cl- b.SO42- c.Br- d.HCO3-
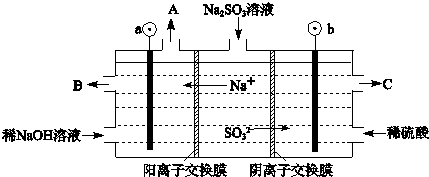
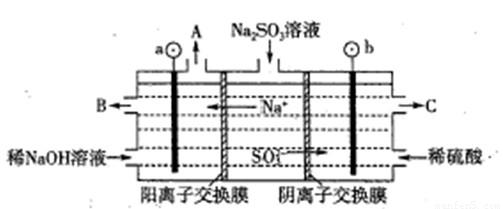
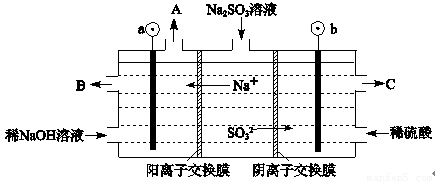
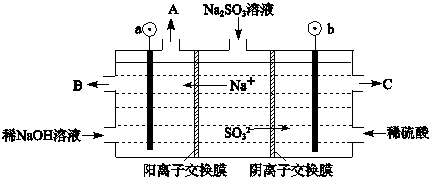
(3)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示.(电极材料为石墨)
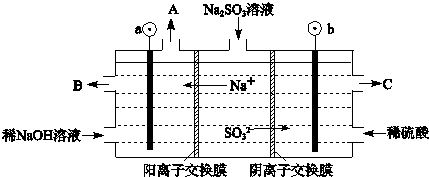
①图中a极要连接电源的(填“正”或“负”)______极,C口流出的物质是______.
②SO32-放电的电极反应式为______.
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因______.
解:(1)向煤中加入石灰石起固硫的作用,该反应的化学方程式是:2SO2+O2+2CaCO3=2CaSO4+2CO2,
故答案为:2SO2+O2+2CaCO3=2CaSO4+2CO2 ;
(2)①含SO2的烟气可利用海水脱硫,向曝气池中通入空气的目的是把H2SO3、HSO3-等氧化为SO42-,故答案为:将H2SO3、HSO3-等氧化为SO42-;
②由上一问可知硫酸根浓度肯定增大,天然海水呈弱碱性,通入空气后曝气池中的海水会生成酸性物质会消耗HCO3-,HCO3-会减少,故答案为:bd;
(3)①根据电解池中阴阳离子的移动方向:阳离子移向阴极可以判断①图中a极要连接电源的负极,SO32-在阳极失去电子变成SO42-,所以C口流出的物质是H2SO4,②SO32-放电的电极反应式为SO32--2e-+H2O=SO42-+2H+;
③在阴极H+放电生成H2,c(H+)减小,水的电离平衡H2O?H++OH-正向移动,所以碱性增强;
故答案为:①负;硫酸; ②SO32--2e-+H2O=SO42-+2H+;③H2O?H++OH-,在阴极H+放电生成H2,c(H+)减小,水的电离平衡正向移动,碱性增强.
分析:(1)向煤中加入石灰石起固硫的作用,该反应的化学方程式是:2SO2+O2+2CaCO3=2CaSO4+2CO2;
(2)①含SO2的烟气可利用海水脱硫,向曝气池中通入空气的目的是把H2SO3、HSO3-等氧化为SO42-;②由上一问可知硫酸根浓度肯定增大,天然海水呈弱碱性,通入空气后曝气池中的海水会生成酸性物质会消耗HCO3-,HCO3-会减少;
(3)①根据电解池中阴阳离子的移动方向:阳离子移向阴极可以判断①图中a极要连接电源的负极,SO32-在阳极失去电子变成SO42-,所以C口流出的物质是H2SO4,②SO32-放电的电极反应式为SO32--2e-+H2O=SO42-+2H+,
③在阴极H+放电生成H2,c(H+)减小,水的电离平衡H2O?H++OH-正向移动,所以碱性增强.
点评:本题是化学与技术的典型题目,仔细分析生产工艺流程,可以看到都是小知识点:电解池阴极阳极的判断 电极反应式的书写 电解液的变化.
故答案为:2SO2+O2+2CaCO3=2CaSO4+2CO2 ;
(2)①含SO2的烟气可利用海水脱硫,向曝气池中通入空气的目的是把H2SO3、HSO3-等氧化为SO42-,故答案为:将H2SO3、HSO3-等氧化为SO42-;
②由上一问可知硫酸根浓度肯定增大,天然海水呈弱碱性,通入空气后曝气池中的海水会生成酸性物质会消耗HCO3-,HCO3-会减少,故答案为:bd;
(3)①根据电解池中阴阳离子的移动方向:阳离子移向阴极可以判断①图中a极要连接电源的负极,SO32-在阳极失去电子变成SO42-,所以C口流出的物质是H2SO4,②SO32-放电的电极反应式为SO32--2e-+H2O=SO42-+2H+;
③在阴极H+放电生成H2,c(H+)减小,水的电离平衡H2O?H++OH-正向移动,所以碱性增强;
故答案为:①负;硫酸; ②SO32--2e-+H2O=SO42-+2H+;③H2O?H++OH-,在阴极H+放电生成H2,c(H+)减小,水的电离平衡正向移动,碱性增强.
分析:(1)向煤中加入石灰石起固硫的作用,该反应的化学方程式是:2SO2+O2+2CaCO3=2CaSO4+2CO2;
(2)①含SO2的烟气可利用海水脱硫,向曝气池中通入空气的目的是把H2SO3、HSO3-等氧化为SO42-;②由上一问可知硫酸根浓度肯定增大,天然海水呈弱碱性,通入空气后曝气池中的海水会生成酸性物质会消耗HCO3-,HCO3-会减少;
(3)①根据电解池中阴阳离子的移动方向:阳离子移向阴极可以判断①图中a极要连接电源的负极,SO32-在阳极失去电子变成SO42-,所以C口流出的物质是H2SO4,②SO32-放电的电极反应式为SO32--2e-+H2O=SO42-+2H+,
③在阴极H+放电生成H2,c(H+)减小,水的电离平衡H2O?H++OH-正向移动,所以碱性增强.
点评:本题是化学与技术的典型题目,仔细分析生产工艺流程,可以看到都是小知识点:电解池阴极阳极的判断 电极反应式的书写 电解液的变化.

练习册系列答案
相关题目