题目内容
研究性学习小组进行SO2的制备及性质探究实验。(1)根据反应Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2↑+H2O,制备SO2气体。
①用下列简图,画出制备并收集SO2的实验装置(含试剂)示意图。
②实验过程中,使用分液漏斗滴加浓硫酸的操作是:________________________。
(2)将SO2气体分别通入下列溶液中:
①品红溶液,现象是____________________________________________________;
②溴水溶液,现象是____________________________________________________;
③硫化钠溶液,现象是__________________________________________________。
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)。
①原因____________,验证方法_________________________________________。
②原因____________,验证方法_________________________________________。
③原因____________,验证方法_________________________________________。
解析:本题以二氧化硫为载体,将其实验室制取原理、实验装置的选择、典型仪器的使用操作、性质检验及实验过程中异常现象的解释有机地结合在一起,考查对气体制备方法的迁移应用能力和实验操作的分析处理能力。
(1)分析制备二氧化硫的反应原理,由制备二氧化硫所用试剂的状态、反应条件确定气体的发生装置;由二氧化硫的性质(密度、水溶性、毒性等)确定其收集装置和吸收装置,在此基础上画出收集二氧化硫的实验装置图。
(2)二氧化硫具有漂白性,可使品红溶液褪色;二氧化硫具有还原性,可被溴水氧化,而使溴水褪色;二氧化硫具有氧化性,能与还原剂硫化钠溶液反应生成单质硫,而使溶液变浑浊。
(3)由题意可知制取二氧化硫过程中,气体产生缓慢,实验现象很不明显,但不是气密性问题,所以只能与所用试剂有关,如Na2SO3变质,被氧化为Na2SO4,或所用液体不是浓硫酸等。
答案:(1)①

(如图配置)
②打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,缓慢滴加。
(2)①溶液褪色 ②溶液褪色 ③有浅黄色沉淀(或溶液变浑浊)
(3)①Na2SO3变质
取待测试样于试管中,加适量蒸馏水配成溶液,先滴入足量稀盐酸,再滴入BaCl2溶液有白色沉淀生成,则证明该Na2SO3固体变质
②不是浓硫酸
用洁净玻璃棒蘸取待测试样,涂白纸上,白纸不变黑,则证明该溶液不是浓硫酸。

向草酸(H2C2O4)溶液中逐滴加入酸性高锰酸钾溶液时,溶液褪色总是先慢后快。对其原因,某研究性学习小组结合化学反应原理提出猜想与假设,并设计了一系列实验进行探究:
实验(1):在两支试管中分别加入10mL等浓度的草酸溶液,在②号试管中加入少量硫酸锰固体。然后在两支试管中分别加入5滴0.1 mol·L-1的硫酸酸化高锰酸钾溶液。现象如下(表1)
|
| ①号试管 | ②号试管 |
| 加入药品 | 草酸溶液 硫酸酸化高锰酸钾溶液 | 草酸溶液 硫酸酸化高锰酸钾溶液 硫酸锰固体 |
| 实验现象(褪色时间) | 溶液褪色很慢(30s) | 溶液褪色很快(2s) |
实验(2):在两支试管中分别加入5 mL等浓度的草酸溶液,在②号试管中再滴加10滴稀硫酸,然后各加入5滴0.1mol·L-1的高锰酸钾溶液。现象如下(表2)
| 编号 | ①号试管 | ②号试管 |
| 褪色时间 现象 | 100 s | 90 s |
| 均有气泡产生;②号试管的溶液褪色比①号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 |
实验(3):取3支试管分别加入5 mL等浓度草酸溶液,然后在①、②、③号试管中依次加入10滴、1 mL、2 mL稀硫酸溶液,各加入5滴0.1 mol·L-1的高锰酸钾溶液,然后置于温度为65℃的水浴中加热。观察现象(表3)。
| 编号 | ①号试管 | ②号试管 | ③号试管 |
| 褪色时间
实验现象 | 80 s | 100 s | 120 s |
| 均有气泡产生;①号试管的溶液褪色比②、③号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 |
(1) 该研究性学习小组的实验目的是 。
(2)该研究性学习小组进行实验时所用的方法是科学实验中常用的一种方法,该方法叫 法;
(3)实验(1)得出的结论是 。
(4)由实验(2)和实验(3)得出的结论是(写三点)
_________________________,_____________________,_______________;
(5)据有关现象写出草酸溶液与酸性高锰酸钾溶液反应的离子方程式:
H2C2O4+ MnO4—+ = Mn2++ + H2O
向草酸(H2C2O4)溶液中逐滴加入酸性高锰酸钾溶液时,溶液褪色总是先慢后快。对其原因,某研究性学习小组结合化学反应原理提出猜想与假设,并设计了一系列实验进行探究:
实验(1):在两支试管中分别加入10mL等浓度的草酸溶液,在②号试管中加入少量硫酸锰固体。然后在两支试管中分别加入5滴0.1 mol·L-1的硫酸酸化高锰酸钾溶液。现象如下(表1)
|
|
①号试管 |
②号试管 |
|
加入药品 |
草酸溶液 硫酸酸化高锰酸钾溶液 |
草酸溶液 硫酸酸化高锰酸钾溶液 硫酸锰固体 |
|
实验现象(褪色时间) |
溶液褪色很慢(30s) |
溶液褪色很快(2s) |
实验(2):在两支试管中分别加入5 mL等浓度的草酸溶液,在②号试管中再滴加10滴稀硫酸,然后各加入5滴0.1 mol·L-1的高锰酸钾溶液。现象如下(表2)
|
编号 |
①号试管 |
②号试管 |
|
褪色时间 现象 |
100 s |
90 s |
|
均有气泡产生;②号试管的溶液褪色比①号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 |
实验(3):取3支试管分别加入5 mL等浓度草酸溶液,然后在①、②、③号试管中依次加入10滴、1 mL、2 mL稀硫酸溶液,各加入5滴0.1 mol·L-1的高锰酸钾溶液,然后置于温度为65℃的水浴中加热。观察现象(表3)。
|
编号 |
①号试管 |
②号试管 |
③号试管 |
|
褪色时间
实验现象 |
80 s |
100 s |
120 s |
|
均有气泡产生;①号试管的溶液褪色比②、③号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 |
(1) 该研究性学习小组的实验目的是 。
(2)该研究性学习小组进行实验时所用的方法是科学实验中常用的一种方法,该方法叫 法;
(3)实验(1)得出的结论是 。
(4)由实验(2)和实验(3)得出的结论是(写三点)
_________________________,_____________________,_______________;
(5)据有关现象写出草酸溶液与酸性高锰酸钾溶液反应的离子方程式:
H2C2O4+ MnO4—+ = Mn2++ + H2O
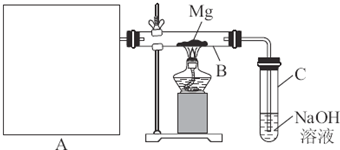

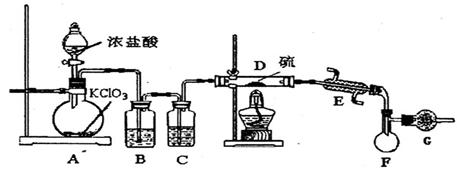
 【查阅资料】① 干燥的氯气在110℃~140℃与硫反应,即可得到S2C12。② S的熔点为112.8℃、沸点为444.6℃;S2C12的熔点为
【查阅资料】① 干燥的氯气在110℃~140℃与硫反应,即可得到S2C12。② S的熔点为112.8℃、沸点为444.6℃;S2C12的熔点为 76℃、沸点为138℃。
76℃、沸点为138℃。 2SCl2。④ S2C12易和水发生反应,生成H2S、SO2、H2SO3、H2SO4等。⑤ClO3-+5Cl-+6H
2SCl2。④ S2C12易和水发生反应,生成H2S、SO2、H2SO3、H2SO4等。⑤ClO3-+5Cl-+6H =3C12↑+3H2O 请回答下列问题:
=3C12↑+3H2O 请回答下列问题: