题目内容
已知Zn(OH)2是两性氢氧化物,与氢氧化钠溶液的反应方程式为:Zn(OH)2+2NaOH=Na2ZnO2+2H2O.现有一块锌铁合金,将其溶于足量盐酸中,再加入过量的NaOH溶液,在空气中静置,当红褐色沉淀不再增加时,将沉淀过滤出并灼烧,得到的固体残留物恰好跟原来合金的质量相等,则此合金中锌的质量分数为( )
| A、19.4% | B、30.0% | C、70.0% | D、80.6% |
分析:锌铁合金与足量的盐酸反应生成ZnCl2、FeCl2,向反应后的溶液中加入过量的NaOH溶液,Zn2+转化为Na2ZnO2,Fe2+转化为Fe(OH)2,进一步氧化,最终得到沉淀为Fe(OH)3,加热灼烧,最终得到固体残留物为Fe2O3,固体残留物恰好跟原来合金的质量相等,则氧化铁中O元素质量等于合金中Zn的质量,进而计算合金中Zn的质量分数.
解答:解:锌铁合金与足量的盐酸反应生成ZnCl2、FeCl2,向反应后的溶液中加入过量的NaOH溶液,Zn2+转化为Na2ZnO2,Fe2+转化为Fe(OH)2,进一步氧化,最终得到沉淀为Fe(OH)3,加热灼烧,最终得到固体残留物为Fe2O3,固体残留物恰好跟原来合金的质量相等,则氧化铁中O元素质量等于合金中Zn的质量,故合金中Zn的质量分数=氧化铁中O元素质量分数=
×100%=30%,
故选B.
| 16×3 |
| 56×2+16×3 |
故选B.
点评:本题考查混合物计算,关键是清楚整个反应过程,利用守恒思想进行解答,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

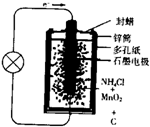
 则负极上的电极反应式是______.MnO2的作用是除去正极上的某产物,本身生成Mn2O3,该反应的化学方程式是______.
则负极上的电极反应式是______.MnO2的作用是除去正极上的某产物,本身生成Mn2O3,该反应的化学方程式是______.
 则负极上的电极反应式是______.MnO2的作用是除去正极上的某产物,本身生成Mn2O3,该反应的化学方程式是______.
则负极上的电极反应式是______.MnO2的作用是除去正极上的某产物,本身生成Mn2O3,该反应的化学方程式是______.