题目内容
某金属元素R的单质0.9g与硫酸完全反应时可生成R2(SO4)3,并生成1.12L氢气(标准状况).已知该元素的原子核中有14个中子.试通过计算确定该元素的名称及其在周期表中位置.
【答案】分析:根据单质和稀硫酸的反应中电子转移守恒,确定R元素原子的相对原子质量,相对原子质量在数值上近似等于质量数,据A=Z+N来确定质子数,确定元素原子的核外电子排布以确定该元素在周期表中的位置.
解答:解:令0.9g金属的物质的量为n,根据电子转移守恒,则:
n×3=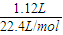 ×2,解得n=
×2,解得n=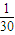 mol,
mol,
所以金属R的摩尔质量为M=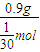 =27g/mol,
=27g/mol,
所以R元素的相对原子质量为27,
R元素原子的质子数为Z=A-N=27-14=13,
故该元素为铝,原子结构示意图为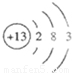 ,位于第三周期第ⅢA族.
,位于第三周期第ⅢA族.
答:该元素的名称为铝,位于元素周期表中第三周期第ⅢA族.
点评:本题考查学生相对原子质量的计算和原子结构决定元素的位置,关键在于运用电子转移守恒计算,难度不大.
解答:解:令0.9g金属的物质的量为n,根据电子转移守恒,则:
n×3=
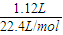 ×2,解得n=
×2,解得n=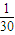 mol,
mol,所以金属R的摩尔质量为M=
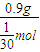 =27g/mol,
=27g/mol,所以R元素的相对原子质量为27,
R元素原子的质子数为Z=A-N=27-14=13,
故该元素为铝,原子结构示意图为
 ,位于第三周期第ⅢA族.
,位于第三周期第ⅢA族.答:该元素的名称为铝,位于元素周期表中第三周期第ⅢA族.
点评:本题考查学生相对原子质量的计算和原子结构决定元素的位置,关键在于运用电子转移守恒计算,难度不大.

练习册系列答案
相关题目