题目内容
6.在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O反应中( )| A. | 该反应中转移电子数为16NA | |
| B. | 氧化产物与还原产物的粒子个数比为2:5 | |
| C. | 氧化剂与还原剂物质的量之比为1:8 | |
| D. | 氧化剂与还原剂物质的量之比为1:5 |
分析 2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,化合价升高的Cl元素被氧化,对应产物Cl2是氧化产物,化合价降低的Mn元素被还原,所在的反应物KMnO4是氧化剂,发生还原反应,对应产物MnCl2是还原产物,在反应的16HCl(浓)中,被氧化的占10mol,未被氧化的HCl为6mol,以此来解答.
解答 解:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,化合价升高的Cl元素被氧化,对应产物Cl2是氧化产物,由原子守恒可知,在反应的16HCl(浓)中,被氧化的占10mol,未被氧化的HCl为6mol,
A.反应中2molKMnO4得到10mol电子,则该反应中转移电子数为16NA,故A错误;
B.Cl2是氧化产物,MnCl2为还原产物,则氧化产物与还原产物的粒子个数比为5:2,故B错误;
C.KMnO4是氧化剂,HCl作还原剂,在反应的16HCl(浓)中,被氧化的占10mol,所以氧化剂与还原剂物质的量之比为2:10=1:5,故C错误;
D.KMnO4是氧化剂,HCl作还原剂,在反应的16HCl(浓)中,被氧化的占10mol,所以氧化剂与还原剂物质的量之比为2:10=1:5,故D正确.
故选D.
点评 本题考查氧化还原反应的计算,把握反应中元素的化合价变化及原子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
16.“铁强化酱油”中不属于铁元素的作用是( )
| A. | 增加酱油的鲜味 | B. | 预防缺铁性贫血病 | ||
| C. | 补充人体需要的铁元素 |
17.下列热化学方程式中,正确的是( )
| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 在101 kPa时,2gH2完全燃烧生成液态水,放出285.8lkJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6 kJ•mol-1 |
14.下列反应的离子方程式中,错误的是( )
| A. | 用稀硫酸清除铁锈:Fe2O3+6H+═2Fe3++3H2O | |
| B. | 铜粉放入硝酸银溶液里:Cu+2Ag+═Cu2++2Ag | |
| C. | 食盐水中滴加硝酸银溶液:Cl-+Ag+═AgCl↓ | |
| D. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
1.下列说法正确的是( )
| A. | 某溶液中加入Ba(NO3)2溶液后产生白色沉淀,则原溶液中一定含有SO42- | |
| B. | 某溶液中滴入几滴AgNO3溶液,产生白色沉淀,说明一定是氯化物的溶液 | |
| C. | 将盛满H2的小试管取出,管口向上靠近酒精灯火焰,检验H2纯度 | |
| D. | 将带火星的木条靠近导管口,木条复燃,说明有氧气生成 |
11.粗略测定草木灰中碳酸钾的含量,需经称量、溶解、过滤、蒸发等操作.下列图示对应的操作不规范的是( )
| A. | 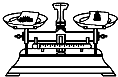 称量 | B. | 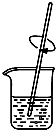 溶解 | C. | 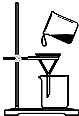 过滤 | D. | 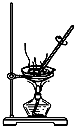 蒸发 |
15.下列物质中不会引起室内空气污染的是( )
| A. | 水果释放出的酯类物质 | |
| B. | 厨房烧饭时产生的油烟 | |
| C. | 地板砖中释放出的氡等放射性物质 | |
| D. | 室内装潢涂料中释放出来的苯、二甲苯 |