题目内容
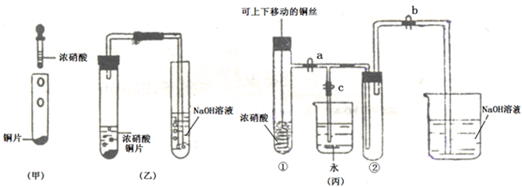
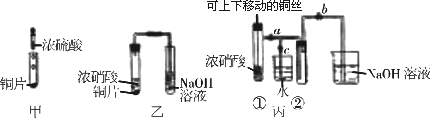
如图甲是旧教材中验证铜与浓硝酸反应的装置,乙是新教材对演示实验改进后的装置,丙是某校师生对乙作进一步改进并对所产生的气体的性质进行探究的装置.

(1)写出铜和浓硝酸反应的化学方程式______.
(2)与甲装置相比,乙装置的优点是______,丙装置除具有乙装置优点外还具有的优点是______.
(3)欲使NO2气体充满试管②,应先______,再打开弹簧夹a和b,当气体充满②后,将铜丝提起与溶液脱离,然后把a、b、c都关闭,并把试管②置于沸水中,则下列各项不变的是______.
A.颜色 B.平均摩尔质量 C.质量 D.压强E.密度
(4)为了验证NO2与水的反应,欲使烧杯中的水进入试管②的操作是______.
(5)试管②中的NO2和水充分反应后,所得溶液物质的量浓度最大值是______mol/L.(气体体积按标准状况计算且不考虑实验过程中NO2的损失)
解:(1)因铜和浓硝酸反应生成硝酸铜、二氧化氮和水,Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.
(2)乙装置能吸收NO2气体,所以无氮的氧化物逸出,可避免环境污染;C装置能控制反应,可使反应随时进行,随时停止.
故答案为:无氮的氧化物逸出,可避免环境污染;可使反应随时进行,随时停止.
(3)为了NO2气体充满②试管,应先关闭c,然后打开a、b.
在25度时试管中的二氧化氮会转化为四氧化二氮,2NO2(g)?N2O4(g)(正反应为放热反应),若把试管置于100度的沸水中.
A.由于该反应是放热反应,置于100℃的沸水中,平衡会逆向移动,NO2增多,那么颜色会变深,故A错误.
B.二氧化氮转化前后,气体的总质量不变,物质的量改变,所以平均摩尔质量改变,故B错误.
C.根据质量守恒定律知,二氧化氮转化前后,物质的总质量不变,故C正确.
D.二氧化氮转化前后,气体的物质的量改变,所以压强改变,故D错误.
E.根据质量守恒定律知,二氧化氮转化前后,物质的总质量不变,试管的容积不变,所以气体的密度始终不变,故E正确.故选CE.
故答案:关闭弹簧夹c;CE.
(4)为了让二氧化氮与水接触发生反,应先关闭b,再关闭a,然后打开c,用手捂住(热水、热毛巾、加热)试管②一段时间后松开.
故答案为:先关闭b,再关闭a,然后打开c,用手捂住(热水、热毛巾、加热)试管②一段时间后松开.
(5)设试管的容积为VL,根据NO2和水反应:
3NO2+H2O=2HNO3+NO
3 2 1
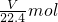
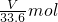

该溶液的溶质是硝酸,因为试管中还有一氧化氮气体占 ,所以溶液的体积为
,所以溶液的体积为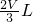 .
.
溶液的物质的量浓度为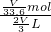 =0.045 mol?L-1.
=0.045 mol?L-1.
故答案为0.045 mol?L-1.
分析:(1)根据铜和浓硝酸反应生成硝酸铜、二氧化氮和水;
(2)根据反应无污染物判断;根据能否控制反应判断.
(3)根据此步骤是为了NO2气体充满②试管;根据方程式2NO2?N2O4判断.
(4)让二氧化氮与水接触发生反应;
(5)根据NO2和水反应,设试管的容积为VL,求出溶质的物质的量及溶液的体积;
点评:本题考查了氮氧化合物的性质等知识点,难度不大,易错题是(3)题,容易忽略二氧化氮和四氧化二氮之间的转化,温度对该反应的影响,错误的认为二氧化氮和沸水反应生成硝酸和一氧化氮,导致选择错误.
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.
(2)乙装置能吸收NO2气体,所以无氮的氧化物逸出,可避免环境污染;C装置能控制反应,可使反应随时进行,随时停止.
故答案为:无氮的氧化物逸出,可避免环境污染;可使反应随时进行,随时停止.
(3)为了NO2气体充满②试管,应先关闭c,然后打开a、b.
在25度时试管中的二氧化氮会转化为四氧化二氮,2NO2(g)?N2O4(g)(正反应为放热反应),若把试管置于100度的沸水中.
A.由于该反应是放热反应,置于100℃的沸水中,平衡会逆向移动,NO2增多,那么颜色会变深,故A错误.
B.二氧化氮转化前后,气体的总质量不变,物质的量改变,所以平均摩尔质量改变,故B错误.
C.根据质量守恒定律知,二氧化氮转化前后,物质的总质量不变,故C正确.
D.二氧化氮转化前后,气体的物质的量改变,所以压强改变,故D错误.
E.根据质量守恒定律知,二氧化氮转化前后,物质的总质量不变,试管的容积不变,所以气体的密度始终不变,故E正确.故选CE.
故答案:关闭弹簧夹c;CE.
(4)为了让二氧化氮与水接触发生反,应先关闭b,再关闭a,然后打开c,用手捂住(热水、热毛巾、加热)试管②一段时间后松开.
故答案为:先关闭b,再关闭a,然后打开c,用手捂住(热水、热毛巾、加热)试管②一段时间后松开.
(5)设试管的容积为VL,根据NO2和水反应:
3NO2+H2O=2HNO3+NO
3 2 1
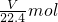
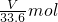

该溶液的溶质是硝酸,因为试管中还有一氧化氮气体占
 ,所以溶液的体积为
,所以溶液的体积为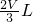 .
.溶液的物质的量浓度为
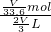 =0.045 mol?L-1.
=0.045 mol?L-1.故答案为0.045 mol?L-1.
分析:(1)根据铜和浓硝酸反应生成硝酸铜、二氧化氮和水;
(2)根据反应无污染物判断;根据能否控制反应判断.
(3)根据此步骤是为了NO2气体充满②试管;根据方程式2NO2?N2O4判断.
(4)让二氧化氮与水接触发生反应;
(5)根据NO2和水反应,设试管的容积为VL,求出溶质的物质的量及溶液的体积;
点评:本题考查了氮氧化合物的性质等知识点,难度不大,易错题是(3)题,容易忽略二氧化氮和四氧化二氮之间的转化,温度对该反应的影响,错误的认为二氧化氮和沸水反应生成硝酸和一氧化氮,导致选择错误.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目