题目内容
9.短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族.下列叙述正确的是( )| A. | 元素W的最高价氧化物对应水化物的酸性比Z的弱 | |
| B. | 化合物YX、ZX2、WX3中化学键的类型相同 | |
| C. | 元素X的简单气态氢化物的沸点比W的高 | |
| D. | 简单离子半径的大小顺序:rW>rY>rX |
分析 短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,X有2个电子层,最外层电子数为6,故X为O元素,W与X属于同一主族,故W为S元素,Y原子的最外层只有2个电子,原子序数大于O元素,故Y处于第三周期,故Y为Mg元素,Z单质可制成半导体材料,Z为Si元素,结合元素化合物的性质解答.
解答 解:短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,X有2个电子层,最外层电子数为6,故X为O元素,W与X属于同一主族,故W为S元素,Y原子的最外层只有2个电子,原子序数大于O元素,故Y处于第三周期,故Y为Mg元素,Z单质可制成半导体材料,Z为Si元素,
A.非金属性S>Si,非金属性越强,则最高价氧化物对应水化物的酸性越强,所以元素W的最高价氧化物对应水化物的酸性比Z的强,故A错误;
B.化合物MgO为离子化合物,含有离子键,SiO2、SO3属于共价化合物,含有共价键,故B错误;
C.O的氢化物分子间存在氢键,沸点较高,所以元素X的简单气态氢化物的沸点比W的高,故C正确;
D.电子层越多离子半径越大,电子排布相同时,原子序数越大,离子半径越小,则简单离子半径的大小顺序:rW>rX>rY,故D错误,
故选:C.
点评 本题考查结构性质与位置关系、元素周期律等,难度不大,推断元素是解题的关键,注意对基础知识的全面掌握.

练习册系列答案
相关题目
17.下列说法正确的是( )
| A. | 实验过程中若皮肤不慎沾上少量碱液,应先用大量水冲洗,然后涂上稀硼酸溶液 | |
| B. | 过滤、结晶、焰色反应、灼烧、萃取、分液和蒸馏等都是常用的分离混合物的方法 | |
| C. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| D. | 检验淀粉是否发生水解,可在溶液中滴加新制氢氧化铜悬浊液,加热至沸腾,若有红色沉淀生成说明已水解,反之则没有水解 |
14.在混合体系中,确认化学反应的先后顺序有利于问题的解决,下列反应的先后顺序的判断正确的是( )
| A. | 在含等物质的量的FeBr2和FeI2溶液中缓慢的通入氯气:I-、Br-、Fe2+ | |
| B. | 在含等物质的量的Fe3+、Cu2+、Fe2+溶液中只加入Zn:Fe3+、Cu2+、Fe2+ | |
| C. | 在含等物质的量的Ba(OH)2和KOH溶液中通入CO2:KOH、Ba(OH)2、BaCO3、K2CO3 | |
| D. | 在含等物质的量的AlO2-、OH-、CO32-的溶液中,逐滴滴加盐酸:AlO2-、Al(OH)3、OH-、CO32- |
1.卤族元素某种性质(A)随核电荷数的变化趋势如图所示,则A不可能表示( )


| A. | 非金属性 | B. | 氢化物的稳定性 | ||
| C. | 单质熔点 | D. | 最高价氧化物对应水化物酸性 |
18.下列说法不正确的是( )
| A. | 通过加热分解HgO可制得单质Hg | |
| B. | 活泼金属Na、Al的冶炼都是通过电解其氧化物水溶液制得的 | |
| C. | 沙里淘金是利用金和沙子的密度不同,从而将金粒分离出来 | |
| D. | 炼铁时,还原剂CO将铁矿石中还原出来 |
19.下列说法正确的是( )
| A. | 常温常压下,22.4LCO2中含有NA个CO2分子 | |
| B. | 标准状况下,4.48LCO含有0.2NA个原子 | |
| C. | 22.4L Cl2中含有NA个Cl2分子 | |
| D. | 标准状况下,1.12LO2和1.12LCO2均含有0.1NA个氧原子 |
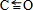 .NH3分子中N原子的杂化方式为sp3杂化,NH3分子的空间立体构型是三角锥形.
.NH3分子中N原子的杂化方式为sp3杂化,NH3分子的空间立体构型是三角锥形.