题目内容
【题目】四氯化钛是乙烯聚合催化剂的重要成分,制备反应如下:
①TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) △H1=+175.4KJ/mol
②C(s)+1/2O2(g)=CO(g) △H2=-110.45 KJ/mol,下列说法正确的是

A. C的燃烧热为110.45KJ/mol
B. 反应①若使用催化剂,△Hl会变小
C. 反应①中的能量变化如图所示
D. 反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) △H=-45.5KJ/mol
【答案】D
【解析】A.C的燃烧热对应完全燃烧产物CO2,故A错误;B. 使用催化剂不改变△H,故B错误;C. 反应①是吸热反应,生成物能量高于反应物,故C错误;D. 反应①+2②得TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) △H=-45.5KJ/mol,故D正确。故选D。

【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol·L-1盐酸、0.55mol·L-1NaOH溶液,尚缺少的实验玻璃用品是______________、_________________。
实验用品 | 溶液温度 | 中和热△H | |||
t1 | t2 | ||||
① | 50mL0.55mol·L-1NaOH | 50mL.0.5mol·L-1HCl | 20℃ | 23.3℃ | _______ |
② | 50mL0.55mol·L-1NaOH | 50mL.0.5mol·L-1HCl | 20℃ | 23.5℃ | |
(2)他们记录的实验数据如下:
已知:Q=Cm(t2-t1),反应后溶液的比热容C为4.18kJ·℃-1·kg-1,各物质的密度均为lg·cm-3。计算完成上表。△H=____________
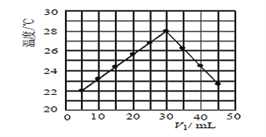
(3)某研究小组将V1mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2 =50mL)。此反应所用NaOH溶液的浓度应为__________mol/L。