题目内容
6.某校化学研究性学习小组的同学在学习了氨的性质时讨论:既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题.请你参与该小组的活动并完成下列研究:(1)制取氨气
①写出实验制取氨气的化学方程式2NH4Cl+Ca(OH)2 $\frac{\underline{\;△\;}}{\;}$ CaCl2+2NH3↑+2H2O;
②在实验室中,还可以用浓氨水与NaOH固体或生石灰或碱石灰等(填写一种试剂)快速制取少量氨气;
③有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铰溶液的方法收集氨气.你认为他能否达到目的?否(填“能”或“否”),理由是氨气极易溶于水、氯化铰对氨气在水中的溶解影响不大.
(2)该小组中某同学设计了如图所示的实验装置(夹持及尾气处理装置未画出),探究氨气的还原性:

该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是在装置A与B之间增加装有碱石灰的干燥管;C装置之后增加尾气吸收装置;
②利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体写出氨气与CuO反应的化学方程式3CuO+2NH3 $\frac{\underline{\;△\;}}{\;}$ 3Cu+N2+3H2O.
(3)问题讨论
有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O.已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(2Cu+→ Cu+Cu2+).请你设计一个简单的实验检验该红色物质中是否含有Cu2O取少许样品,加入稀硫酸,若溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有.
分析 (1)①实验室常用熟石灰和氯化铵混合加热制取氨气;
②用浓氨水与NaOH固体或生石灰或碱石灰等混合可以迅速制备少量氨气;
③氨气极易溶于水,氯化铵对氨气的溶解性影响不大;
(2)①氯化铵和消石灰反应生成氨气和水,氨气和CuO反应前应先干燥,C装置之后增加尾气吸收装置;
②由题意可知生成物为铜、氮气和水,以此书写化学方程式;
(3)根据Cu2O在酸性条件下不稳定的性质分析,在酸性溶液中,Cu+的稳定性比Cu2+差,(即2Cu+→Cu+Cu2+).因此可利用生成的Cu2+在溶液中显蓝色来验证,但所用的酸一定不能是氧化性酸.
解答 解:(1)①实验室用氯化铵和消石灰反应制备氨气,反应的化学方程式为2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
②用浓氨水与NaOH固体或生石灰或碱石灰等混合可以迅速制备少量氨气,
故答案为:NaOH固体或生石灰或碱石灰等;
③氨气极易溶于水、氯化铵对氨气在水中的溶解影响不大,所以不能用用排饱和氯化铵溶液的方法收集氨气,
故答案为:否;氨气极易溶于水、氯化铵对氨气在水中的溶解影响不大;
(2)①氯化铵和消石灰反应生成氨气和水,氨气和CuO反应前应先干燥,氨气污染空气,C装置后需要连接尾气吸收装置,
故答案为:在装置A与B之间增加装有碱石灰的干燥管;C装置之后增加尾气吸收装置;
②CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体,说明生成铜、氮气和水,反应的化学方程式为3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O,
故答案为:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O;
(3)由题中信息可知,Cu2O是一种碱性氧化物,在酸性溶液中,Cu+的稳定性比Cu2+差(2Cu+=Cu+Cu2+),则将Cu2O加入硫酸中发生:Cu2O+H2SO4=CuSO4+Cu+H2O,可观察到溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有,
故答案为:取少许样品,加入稀硫酸,若溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有.
点评 本题考查氨气的制备方法及化学性质,题目难度中等,明确氨气的性质及实验基本操作方法是解题关键,试题侧重考查学生的分析、理解能力及化学实验能力.

| X | Y | Z | |
| ① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| ② | KOH溶液 | SiO2 | 稀盐酸 |
| ③ | O2 | S | H2 |
| ④ | FeCl3溶液 | Fe | 稀硫酸 |
| A. | ①③ | B. | ①④ | C. | ②④ | D. | ②③ |
 在T℃时,将一定量A加入到体积为2L的某密闭容器中,发生以下化学反应:2A(g)?B(g)+C(g)△H=-akJ/mol.反应在第15min时达到平衡,反应过程中B、A的浓度比与时间t有如图所示关系,若测得第15min时c(B)=0.8mol/L,下列结论正确的是( )
在T℃时,将一定量A加入到体积为2L的某密闭容器中,发生以下化学反应:2A(g)?B(g)+C(g)△H=-akJ/mol.反应在第15min时达到平衡,反应过程中B、A的浓度比与时间t有如图所示关系,若测得第15min时c(B)=0.8mol/L,下列结论正确的是( )| A. | 反应达平衡时,A的转化率为80% | |
| B. | A的初始物质的量为2mol | |
| C. | 反应到达平衡时,放出的热量是2a KJ | |
| D. | 15min时,v正=v逆=0 |
| A. | 常温下,1 L 0.1 mol/L的NH4NO3溶液中氢原子总数为0.4NA | |
| B. | 0.5 mol 甲基中电子数为5NA | |
| C. | 在反应3Br2+3CO32-=5Br-+BrO3-+3CO2↑中,每生成3 mol CO2转移的电子数为5NA | |
| D. | 常温常压下,22.4 L N2H4中N-H键数为4NA |
| A. | 2 mol | B. | 3.5 mol | C. | 0.5 mol | D. | 1 mol |
| 实验序号 | ① | ② | ③ | ④ |
| M(粉末样品)/g | 0.90 | 1.80 | 3.60 | 7.20 |
| M(反应后剩余固体)/g | 0 | 0.64 | 2.48 | 6.08 |
(2)原粉末样品中m(Fe):m(Cu)=7:8.
| A. |  图可以表示Si、P、S、Cl四种元素的最低负化合价的绝对值 | |
| B. | 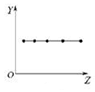 图可以表示ⅡA族元素的原子最外层电子数 | |
| C. |  图可以表示ⅥA族元素气态氢化物的稳定性 | |
| D. | 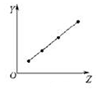 图可以表示第三周期非金属元素的最高价氧化物对应水化物的酸性 |
