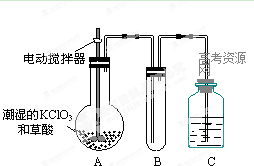
题目内容
(10分)二氧化氯![]() 是一种在水处理等方面有广泛应用的高效安全消毒剂。与
是一种在水处理等方面有广泛应用的高效安全消毒剂。与![]() 相比,
相比,![]() 不但具有更显著地杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
不但具有更显著地杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(1)在![]() 的制备方法中,有下列两种制备方法:
的制备方法中,有下列两种制备方法:
方法一:![]() ====
====![]()
方法二:![]() ====
====![]()
![]() 用方法二制备的
用方法二制备的![]() 更适合用于饮用水的消毒,其主要原因是 。
更适合用于饮用水的消毒,其主要原因是 。
![]() (2)用
(2)用![]() 处理过的饮用水(
处理过的饮用水(![]() 为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子
为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子![]() .2001年我国卫生部规定,饮用水
.2001年我国卫生部规定,饮用水![]() 的含量应不超过0.2
的含量应不超过0.2![]() 饮用水中
饮用水中![]() 、
、![]() 的含量可用连续碘量法进行测定。
的含量可用连续碘量法进行测定。![]() 被
被![]() 还原为
还原为![]() 、
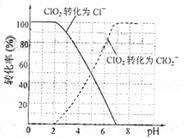
、![]() 的转化率与溶液PH的关系如右图所示。当
的转化率与溶液PH的关系如右图所示。当![]() 时,
时,![]() 也能被
也能被 完全还原成
完全还原成![]() 。反应生成的
。反应生成的![]() 用标准
用标准![]() 溶液滴定:
溶液滴定:
![]() ====
====![]()
① 请写出![]() 时,
时,![]() 与
与![]() 反应的离子方程式 。
反应的离子方程式 。
②请完成相应的实验步骤:
步骤1:准确量取![]() 水样加入到锥形瓶中。
水样加入到锥形瓶中。
步骤2:调节水样的![]() 为7.0~8.0
为7.0~8.0
步骤3:加入足量的![]() 晶体。
晶体。
步骤4:加少量淀粉溶液,用![]()
![]()
![]() 溶液滴定至终点,消耗
溶液滴定至终点,消耗![]() 溶液
溶液![]() .
.
步骤5: 。
步骤6;再用![]()
![]()
![]() 溶液滴定至终点,消耗
溶液滴定至终点,消耗![]() 溶液
溶液![]() 。
。
③根据上述分析数据,测得该引用水样中的![]() 的浓度为
的浓度为 ![]() (用含字母的代数式表示)。
(用含字母的代数式表示)。
④若饮用水中![]() 的含量超标,可向其中加入适量的,该反应的氧化产物是 (填化学式)
的含量超标,可向其中加入适量的,该反应的氧化产物是 (填化学式)
(1)方法二制备的ClO2中不含Cl2
(2)①![]()
②调节溶液的![]()
③![]()
④![]()
![]()
 【解析】(1)比较简单,观察两组方程式,看看产物结合其性质即能得出答案。(2)
【解析】(1)比较简单,观察两组方程式,看看产物结合其性质即能得出答案。(2)![]() 时,
时,![]() 也能被
也能被![]()
![]() 完全还原成
完全还原成![]() ,那么
,那么![]() 要被氧化为碘单质,溶液是酸性溶液即可正确写出离子方程式。题目信息提示用的是连续碘量法进行测定,步骤6又用
要被氧化为碘单质,溶液是酸性溶液即可正确写出离子方程式。题目信息提示用的是连续碘量法进行测定,步骤6又用![]() 溶液滴定至终点,说明步骤5中有碘生成,结合① 请写出
溶液滴定至终点,说明步骤5中有碘生成,结合① 请写出![]() 时,
时,![]() 与
与![]() 反应的离子方程式与
反应的离子方程式与![]() 为7.0~8.0的溶液中存在ClO-可以判断调节溶液的
为7.0~8.0的溶液中存在ClO-可以判断调节溶液的![]() 。求引用水样中的
。求引用水样中的![]() 的浓度可以用关系式法以碘单质为桥梁正确的找准
的浓度可以用关系式法以碘单质为桥梁正确的找准![]() 与
与![]() 的关系。Fe2+将
的关系。Fe2+将![]() 还原成
还原成![]() Fe2+ 被氧化为铁离子,结合反应物不难得出答案
Fe2+ 被氧化为铁离子,结合反应物不难得出答案

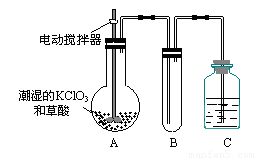
作为世界卫生组织(WHO)推荐的A1级广谱、安全、高效消毒剂,二氧化氯(ClO2)在水处
| 理领域有着广泛应用。与氯气相比,它不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。 (1)反应时,ClO2生成ClO2—、Cl—的转化率与溶液的pH的关系如图所示。则pH= 8时,ClO2被还原为_____________。 |
|
(2)亚氯酸根离子(ClO2—)对人体不利。欲在弱碱性条件下将水中的ClO2—转化为Cl—除去,若该反应体系中的物质有:NaClO2、Fe(OH)3、NaHCO3、FeCl2、NaCl、H2O、CO2。写出、配平有关化学方程式,并标出电子转移的方向和数目:
_____________________________________________________________________________。
(3)以下是ClO2的两种制备方法:
方法一:2NaClO3 + 4HCl → 2ClO2↑+ Cl2↑+ 2NaCl + 2H2O
方法二:2NaClO3 + H2O2 + H2SO4→ 2ClO2↑+ O2↑+ Na2SO4 + 2H2O
① 方法一,当有0.2mol电子发生转移时,参与反应的还原剂为_________mol。
② 方法二:该反应中H2O2_________(填序号)。
a. 发生氧化反应 b. 仅做氧化剂 c. 既被氧化又被还原 d. 既未被氧化也未被还原
③ 用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是___________________。
作为世界卫生组织(WHO)推荐的A1级广谱、安全、高效消毒剂,二氧化氯(ClO2)在水处
|
理领域有着广泛应用。与氯气相比,它不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。 (1)反应时,ClO2生成ClO2—、Cl—的转化率与溶液的pH的关系如图所示。则pH= 8时,ClO2被还原为_____________。 |
|
(2)亚氯酸根离子(ClO2—)对人体不利。欲在弱碱性条件下将水中的ClO2—转化为Cl—除去,若该反应体系中的物质有:NaClO2、Fe(OH)3、NaHCO3、FeCl2、NaCl、H2O、CO2。写出、配平有关化学方程式,并标出电子转移的方向和数目:
_____________________________________________________________________________。
(3)以下是ClO2的两种制备方法:
方法一:2NaClO3 + 4HCl → 2ClO2↑+ Cl2↑+ 2NaCl + 2H2O
方法二:2NaClO3 + H2O2 + H2SO4 → 2ClO2↑+ O2↑+ Na2SO4 + 2H2O
① 方法一,当有0.2mol电子发生转移时,参与反应的还原剂为_________ mol。
② 方法二:该反应中H2O2_________(填序号)。
a. 发生氧化反应 b. 仅做氧化剂 c. 既被氧化又被还原 d. 既未被氧化也未被还原
③ 用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是___________________。