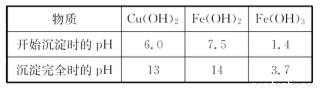
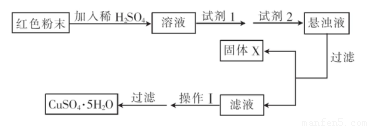
题目内容
有氧化铜和三氧化二铁的混合物ag,加入2mol/L的HCl溶液50mL,恰好完全溶解,若用H2将ag该混合物还原,得到金属的质量为 ( )
A.(a-0.8)g B.(a-1.6)g C.1.6ag D.0.8ag
A
解析:
50mL 2mol/L的HCl溶液中n(HCl)=0.1mol ,则反应后生成的CuCl2和FeCl3中n(Cl-)=0.1mol ,根据电荷守恒,则原混合物中n(O)=0.05mol,用H2还原后所得金属的质量为ag-0.05mol×16g/mol=(a-0.8)g 。

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目