题目内容
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A、在0.1 mol?L-1 NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| B、在0.1 mol?L-1 Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) |
| C、向0.2 mol?L-1 NaHCO3溶液中加入等体积0.1 mol?L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D、常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol?L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A.碳酸氢钠溶液呈碱性,说明HCO3-的水解程度大于电离程度,但都较微弱;
B.溶液中存在质子守恒,根据质子守恒判断;
C.二者混合后溶液中的溶质为等物质的量浓度的NaHCO3和Na2CO3,碳酸根离子水解程度大于碳酸氢根离子水解程度,混合溶液呈碱性;
D.混合溶液呈中性,则c(H+)=c(OH-).
B.溶液中存在质子守恒,根据质子守恒判断;
C.二者混合后溶液中的溶质为等物质的量浓度的NaHCO3和Na2CO3,碳酸根离子水解程度大于碳酸氢根离子水解程度,混合溶液呈碱性;
D.混合溶液呈中性,则c(H+)=c(OH-).
解答:
解:A.碳酸氢钠溶液呈碱性,说明HCO3-的水解程度大于电离程度,但都较微弱,钠离子不水解,所以溶液中离子浓度大小顺序是c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故A错误;
B.溶液中存在质子守恒,根据质子守恒得c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),所以得c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3),故B正确;
C.二者混合后溶液中的溶质为等物质的量浓度的NaHCO3和Na2CO3,碳酸根离子水解程度大于碳酸氢根离子水解程度,所以c(CO32-)<c(HCO3-),故C错误;
D.混合溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(Na+)=c(CH3COO-),溶液中存在部分醋酸,其浓度大于溶液中氢离子浓度,所以溶液中离子浓度大小顺序是c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-),故D错误;
故选B.
B.溶液中存在质子守恒,根据质子守恒得c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),所以得c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3),故B正确;
C.二者混合后溶液中的溶质为等物质的量浓度的NaHCO3和Na2CO3,碳酸根离子水解程度大于碳酸氢根离子水解程度,所以c(CO32-)<c(HCO3-),故C错误;
D.混合溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(Na+)=c(CH3COO-),溶液中存在部分醋酸,其浓度大于溶液中氢离子浓度,所以溶液中离子浓度大小顺序是c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-),故D错误;
故选B.
点评:本题考查了离子浓度大小比较,明确溶液中的溶质及溶液酸碱性、溶质的性质即可解答,再结合守恒思想分析,易错选项是C,根据酸根离子水解程度大小判断即可,为易错点.

练习册系列答案
相关题目
下列各组物质间的反应与反应类型不相符的是( )
| A、乙烯与溴水(加成反应) |
| B、苯与浓硝酸(硝化反应) |
| C、氯乙烷与氢氧化钠醇溶液 (取代反应) |
| D、乙稀与高锰酸钾(氧化反应) |
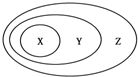 用如图表示的一些物质或概念之间的从属或包含关系中不正确的是( )
用如图表示的一些物质或概念之间的从属或包含关系中不正确的是( )| X | Y | Z | |
| 例 | 氧化物 | 化合物 | 纯净物 |
| A | 含氧酸 | 酸 | 化合物 |
| B | 溶液 | 分散系 | 混合物 |
| C | 强电解质 | 电解质 | 化合物 |
| D | 单质 | 化合物 | 纯净物 |
| A、A | B、B | C、C | D、D |
下列说法中肯定错误的是( )
| A、某原子K层上只有一个电子 |
| B、某原子M层上电子数为L层电子数的4倍 |
| C、某离子M层上和L层上的电子数均为K层的4倍 |
| D、阳离子的最外层电子数可能为2,也可能为8 |
下列溶液中,一定能大量共存的离子组是( )
| A、能使氢氧化铝迅速溶解的溶液:Na+、Fe2+、NO3-、SO42- |
| B、能使酚酞试液变红的溶液:Na+、NH4+、CO32-、SO42- |
| C、含有大量SO42-的透明溶液:K+、Cu2+、Cl-、NO3- |
| D、含有大量ClO-的溶液:H+、Mg2+、I-、SO42- |
对符号
Cl的理解正确的是( )
35 17 |
| A、氯元素的一种原子的相对原子质量是35 |
| B、氯元素的一种原子的质子数是35 |
| C、氯元素的一种原子的质量数是17 |
| D、氯元素的一种原子的原子核内中子数是18 |
由乙炔(C2H2)、苯(C6H6)、苯乙烯(C8H8)和乙醛(CH3CHO)组成的混合物中碳的质量分数为60%,则氢的质量分数为( )
| A、5% | B、8.9% |
| C、17.8% | D、无法确定 |
将苯分子中的一个碳原子换成一个氮原子,得到一种类似苯环结构的稳定有机物,该有机物的一氯代物有几种( )
| A、1 | B、3 | C、4 | D、5 |