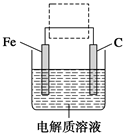
题目内容
钓鱼岛群岛的东海海域及部分太平洋海域探明为海底热水矿床.海底热水矿床是沉积着由岩浆热气从地底喷出金、铜、锌、稀有金属等区域.下列说法正确的是
| A.金不溶于任何溶液 |
| B.铜、锌在空气中被氧化后的最后产物均为对应的氧化物 |
| C.铜锌合金的熔点低于铜或锌的熔点 |
D.稀有金属原子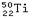 质子数和中子数之差为28 质子数和中子数之差为28 |
C
解析试题分析:A、金一般不溶于酸,但能溶于“王水”,错误;B、铜在空气中与氧气、水、二氧化碳反应最终生成碱式碳酸铜,错误;C、合金的熔点低于组分的熔点,正确;D、Ti的质子数是22,中子数是28,所以二者相差6,错误,答案选C。
考点:考查金、铜、锌的化学性质、合金的性质及钛的原子结构

练习册系列答案
相关题目
下列各表述与示意图图中一致的是 ( )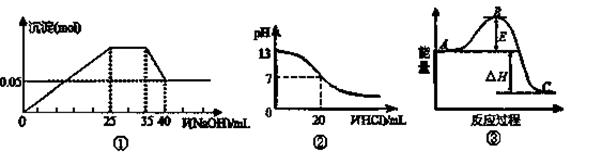
| A.图②表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH 随加入酸体积的变化 |
| B.图①中使用的NaOH的浓度一定为2 mol/L |
| C.图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图。则三种离子的物质的量之比为:n(Mg2+)∶n(Al3+):n( NH4+)=2∶3∶2 |
D.图③中曲线表示3H2(g)+N2(g) 2NH3(g)反应过程能量变化,若使用催化剂,B点会升高 2NH3(g)反应过程能量变化,若使用催化剂,B点会升高 |
下列有关化学实验叙述正确的是( )
| A.少量金属钠保存在四氯化碳中 |
| B.存放浓硝酸时,使用带橡胶塞的棕色试剂瓶 |
| C.将金属钠投入到足量CuSO4溶液中,静置后溶液质量增加 |
| D.容量瓶、分液漏斗使用前都必须检查是否漏水 |
某溶液中可能含有大量的Mg2+、Al3+、H+、Cl-和少量OH-,向该溶液中逐滴加入0.5 mol·L-1的NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积之间的关系如图所示,则该溶液中( )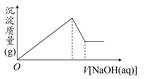
| A.有Mg2+,没有Al3+ |
| B.有Al3+,没有Mg2+ |
| C.有大量的H+、Mg2+和Al3+ |
| D.有Mg2+和Al3+ |
下列关于铁及其化合物的有关说法正确的是( )
| A.赤铁矿的主要成分是Fe3O4 |
| B.铁与水蒸气在高温下的反应产物为Fe2O3和H2 |
| C.除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤 |
| D.Fe3+与KSCN溶液反应产生红色沉淀 |
化学知识在生产和生活中有着重要的应用,下列说法不正确的是( )
| A.明矾常做净水剂 |
| B.与铜质水龙头连接处的钢质水管易发生腐蚀 |
| C.发酵粉中含有较多的NaHCO3,能使焙制出的糕点疏松多孔 |
| D.金属钠、金属镁等活泼金属着火时,可以使用泡沫灭火器来灭火 |
下列对于过氧化钠的叙述中,正确的是( )
| A.将少量Na2O2投入紫色石蕊试液中,溶液最终呈蓝色 |
| B.1 mol Na2O2与H2O完全反应,转移2 mol电子 |
| C.充分加热等物质的量的Na2O2和NaHCO3的混合物,剩余物质为Na2CO3 |
| D.a g CO和H2的混合气体充分燃烧的产物与足量的Na2O2充分反应后,固体质量增加a g |
下述实验设计能够达到目的的是( )
| 编号 | 实验目的 | 实验设计 |
| A | 除去Fe2O3中的少量Al2O3 | 向混合物中滴加足量NaOH溶液,过滤 |
| B | 除去Cu粉中混有的CuO | 向混合物中滴加适量稀硝酸,过滤 |
| C | 证明钠的金属活动性比铝强 | 向AlCl3溶液中投入金属钠 |
| D | 实验室制备Al(OH)3 | 向Al2(SO4)3溶液中加入足量NaOH溶液,过滤 |
 6SO2+Fe3O4,有3 mol FeS2参加反应,转移________ mol电子。
6SO2+Fe3O4,有3 mol FeS2参加反应,转移________ mol电子。