��Ŀ����
����Ŀ���������������Ӫ�����ʣ��������������������������CO2��ˮ����ȱ������������һ���л���A��
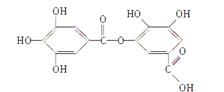
��֪A�ɽ�������ͼ��ʾ�ķ�Ӧ������C��C����ͬϵ�C���Ǽ���(HCOOH)��FΪ�߷��ӻ����
�ش��������⣺
��1��D��D������(�ñ�����룬��ͬ)��
��ͬϵ�� ��ͬ���칹�� ��ͬ������ ��ͬ��������
��2��D���E�ֱ�������һ����
D�� �� E��
�ٶ�Ԫ�� ��ȩ �۲��������� �ܶ�Ԫ���� ����
��3��д���ṹ��ʽ��A �� F �� H��
��4��д����Ӧ���ͣ�
(��)��
(��)��
���𰸡�
��1����
��2���ܣ���
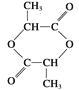
��3�� ��
��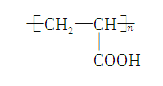 ��
��
��4����ȥ��Ӧ���Ӿ۷�Ӧ
����������������ȱ�������·ֽ���������(  )���������Ϣ��
)���������Ϣ�� 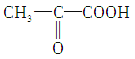 ��һ����������������������Ӧ1������HCOOH(C��)��HOOC��COOH(D��)����������Ӧ2������CH3COOH(C)��H2CO3(D)�����ͼʾ���ʼ��ת����ϵ���������ѵõ��𰸡�
��һ����������������������Ӧ1������HCOOH(C��)��HOOC��COOH(D��)����������Ӧ2������CH3COOH(C)��H2CO3(D)�����ͼʾ���ʼ��ת����ϵ���������ѵõ��𰸡�

 ��ĩ1�����ʽ���������ϵ�д�
��ĩ1�����ʽ���������ϵ�д�����Ŀ��MnO2��п������ɵ�ص���Ҫԭ��
��ⷨ����MnO2��ͳ�Ĺ�����Ҫ����Ϊ�����̿��ú��ԭ���գ���������������ϣ�����Һ����Ҫ��Mn2+�����������ٽ��е�⣬MnO2�ڵ��ص�����������
90������ڷ���������MnO2��п���¹��գ���Ҫ�Dz������̿���Ҫ�ɷ�ΪMnO2 �� ������Al2O3��SiO2���ʣ�����п����Ҫ�ɷ�ΪZnS��������FeS��CuS��CdS���ʣ�Ϊ��Ҫԭ�ϣ��������Ӻõ���Zn2+��Mn2+���ӵ���Һ����ͨ�����ͬʱ���MnO2��п�������̿�ͼ���£��м����Ĺ��岿���Ѿ���ȥ����
[���̿���п��] ![]() [��ҺA]
[��ҺA] ![]() [Zn2+��Mn2+��Fe2+��Al3+]
[Zn2+��Mn2+��Fe2+��Al3+] ![]() [ZnSO4��MnSO4��Һ]
[ZnSO4��MnSO4��Һ] ![]() [Zn+MnO2+��ƷD]
[Zn+MnO2+��ƷD]
��֪���ֽ���������ȫ������pH���±���
Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
�ش��������⣺
��1��������У����̿���п�����������Һ����ʱ������ķ�ӦΪ������ԭ��Ӧ�����磺MnO2+ZnS+2H2SO4�TMnSO4+ZnSO4+S��+2H2O����д��MnO2��������Һ�зֱ��CuS��FeS������Ӧ�Ļ�ѧ����ʽ�� ��
��2������ڼ������п��Ϊ�˻��ս��������ս�������Ҫ�ɷ�Ϊ���û�ѧ���ű�ʾ��
��3�����������C�ɶ���������ɣ����к������ֹ��壬����һ��ΪMnO2 �� ������������һ�ֹ������ʿ�Ϊ ��
��4��������е�������MnO2�������������õ缫�Ϸ����ķ�Ӧ����ʽΪ �� ��ƷD�Ļ�ѧʽΪ �� �����ʶ����������������� ��