��Ŀ����
 ��2009?��Ǩ��ģ���״����ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ���������ַ�Ӧԭ���ǣ�
��2009?��Ǩ��ģ���״����ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ���������ַ�Ӧԭ���ǣ���CH3OH��g��+H2O��g��=CO2��g��+3H2��g����H1=49.0kJ?mol-1
��CH3OH��g��+
| 1 |
| 2 |
����˵����ȷ���ǣ�������
������A���������ʵ�������С�����ʵ�״̬��ϵ���жϣ�
B�����ݡ�H=������������-��Ӧ�����������жϣ�
C��������֪�ļ״�ת��Ϊ���������仯������
D�����ø�˹���ɷ�����
B�����ݡ�H=������������-��Ӧ�����������жϣ�
C��������֪�ļ״�ת��Ϊ���������仯������
D�����ø�˹���ɷ�����
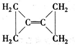
����⣺A��ͬ���ʵ�����ͬ�����ʣ���̬������ߣ����Һ̬��������̬������ͣ��ɢ���֪��Ӧ��CH3OH��l��+
O2��g��=CO2��g��+2H2��g���ġ�H��-192.9kJ?mol-1����A��ȷ��
B���ڷ�Ӧ���У���ͼʾ��H=������������-��Ӧ��������=E1-E2����B����
C������֪��֪����Ӧ��Ϊ���ȷ�Ӧ����C����
D�����ݸ�˹���ɽ����ڡ�3-�١�2�ɵã�CH3OH��g��+
O2��g��=CO2��g��+2H2O��l����H=-192.9kJ/mol��3-49kJ/mol��2=-676.7kJ/mol�����Լ״���ȼ����Ϊ676.7kJ/mol����D����
��ѡA��
| 1 |
| 2 |
B���ڷ�Ӧ���У���ͼʾ��H=������������-��Ӧ��������=E1-E2����B����
C������֪��֪����Ӧ��Ϊ���ȷ�Ӧ����C����
D�����ݸ�˹���ɽ����ڡ�3-�١�2�ɵã�CH3OH��g��+
| 3 |
| 2 |
��ѡA��
���������⿼�黯ѧ�������ܵ��ת���Լ���Ӧ�ȵļ��㣮ע���ڱȽϷ�Ӧ�ȴ�СʱҪ�����űȽϣ�

��ϰ��ϵ�д�
�����Ŀ