题目内容
【题目】常温下,在 pH=4 的醋酸溶液中存在如下电离平衡:CH3COOH ![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
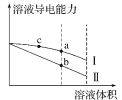
A.加入水时,平衡向右移动,溶液 pH 增大,导电能力增强
B.加入少量 CH3COONa 固体,平衡向左移动,电离常数变小
C.加入少量 NaOH 固体,平衡向右移动,c(H+)减少
D.升高温度,平衡向右移动,CH3COOH 电离常数不变
【答案】C
【解析】
A. 加入水时,醋酸的电离平衡向右移动,但是溶液中离子浓度降低,导电能力减弱,故A错误;
B. 加入少量CH3COONa固体,由于c(CH3COO-)增大,电离平衡向左移动,但是电离常数不变,故B错误;
C. 加入少量NaOH固体,由于c(OH-)增大,消耗酸电离产生的H+,使醋酸的电离平衡向右移动,但是由于平衡移动的趋势是微弱的,总的来说c(H+)减小,故C正确;
D. 升高温度,平衡向右移动,但是CH3COOH 电离常数改变了,故D错误;
正确答案是C。

练习册系列答案
相关题目