题目内容
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一 滴定法 用酸性KMnO4溶液滴定测定铁元素的含量。
反应原理:5Fe2++MnO4—+8H+===5Fe3++Mn2++4H2O
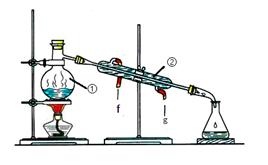
(1)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需________(填仪器名称)。
(2)上述实验中KMnO4溶液需要酸化,用于酸化的酸是________。
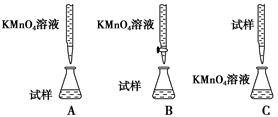
(3)某同学设计的下列滴定方式中,最合理的是________(夹持部分略去)(填字母序号)。
方案二 重量法 操作流程如下:
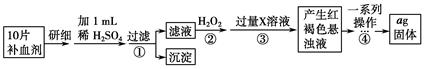
(4)步骤②中除用H2O2外还可以使用的物质是__________________________。
(5)步骤②是否可以省略________,理由是________________________________
_______________________________________。
(6)步骤④中一系列操作依次是:过滤、洗涤、________、冷却、称量。
(7)假设实验无损耗,则每片补血剂含铁元素的质量________g(用含a的代数式表示)。
方案一 滴定法 用酸性KMnO4溶液滴定测定铁元素的含量。
反应原理:5Fe2++MnO4—+8H+===5Fe3++Mn2++4H2O
(1)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需________(填仪器名称)。
(2)上述实验中KMnO4溶液需要酸化,用于酸化的酸是________。
| A.稀硫酸 | B.浓硝酸 | C.稀硝酸 | D.稀盐酸 |

方案二 重量法 操作流程如下:

(4)步骤②中除用H2O2外还可以使用的物质是__________________________。
(5)步骤②是否可以省略________,理由是________________________________
_______________________________________。
(6)步骤④中一系列操作依次是:过滤、洗涤、________、冷却、称量。
(7)假设实验无损耗,则每片补血剂含铁元素的质量________g(用含a的代数式表示)。
(1)250 mL容量瓶 (2)A (3)B (4)氯水(等其他合理的氧化剂) (5)不能 因为Fe2+与碱反应后在空气中加热不能得到纯净的Fe2O3,故无法准确计算Fe的含量 (6)灼烧 (7)0.07a
(1)据题意,配制一定物质的量浓度的KMnO4溶液250 mL,还需250 mL容量瓶(必须带上容量瓶的规格)。(2)由于高锰酸钾有强氧化性不能用盐酸酸化,也不用强氧化性酸(硝酸)酸化,通常用稀硫酸酸化。(3)由于高锰酸钾有强氧化性会腐蚀橡皮管,故只能用酸式滴定管(B装置)进行滴定实验。(4)除用H2O2外还可以使用氯水氧化Fe2+,不引入新的杂质离子。(5)因为Fe2+与碱反应后在空气中加热不能得到纯净的Fe2O3,无法准确计算Fe的含量,所以必须先用H2O2氧化Fe2+来实现。(6)步骤④依次将Fe(OH)3过滤、洗涤、灼烧(Fe(OH)3分解得Fe2O3、冷却、称量。(7)每片补血剂含铁元素的质量:a g÷160 g·mol-1×2×56 g·mol-1÷10片=0.07a g/片

练习册系列答案
相关题目