题目内容
(4分)常温下,浓度均为0.1 mol·L-1的①NaHCO3 ②NaClO ③NH4Cl ④NaCl ⑤Na2CO3五种溶液的pH由大到小的顺序是___________。
②>⑤>①>④>③
NaHCO3、Na2CO3、NaClO属于弱酸强碱盐,水解呈碱性,溶液的pH>7。同一弱酸的正盐在相同条件下的水解程度大于酸式盐,Na2CO3是正盐,NaHCO3是酸式盐,Na2CO3溶液的pH大于NaHCO3溶液。酸越弱,对应盐的水解程度越大,溶液的碱性越强。HClO电离出H+的能力弱于H2CO3及HCO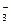 的酸性,Na2CO3、NaHCO3溶液的pH小于NaClO溶液。NaCl是强酸强碱盐,不水解,溶液的pH=7。NH4Cl是强酸弱碱盐,水解呈酸性,溶液的pH<7。综上所述,溶液的pH由大到小的顺序是②>⑤>①>④>③。
的酸性,Na2CO3、NaHCO3溶液的pH小于NaClO溶液。NaCl是强酸强碱盐,不水解,溶液的pH=7。NH4Cl是强酸弱碱盐,水解呈酸性,溶液的pH<7。综上所述,溶液的pH由大到小的顺序是②>⑤>①>④>③。
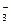 的酸性,Na2CO3、NaHCO3溶液的pH小于NaClO溶液。NaCl是强酸强碱盐,不水解,溶液的pH=7。NH4Cl是强酸弱碱盐,水解呈酸性,溶液的pH<7。综上所述,溶液的pH由大到小的顺序是②>⑤>①>④>③。
的酸性,Na2CO3、NaHCO3溶液的pH小于NaClO溶液。NaCl是强酸强碱盐,不水解,溶液的pH=7。NH4Cl是强酸弱碱盐,水解呈酸性,溶液的pH<7。综上所述,溶液的pH由大到小的顺序是②>⑤>①>④>③。
练习册系列答案
相关题目

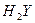 的电离方程式为H2Y H++HY-
的电离方程式为H2Y H++HY-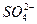 、
、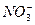 、OH-中的四种。若各自单独排放会造成较大污染,如果混合后再排放,则会大大降低污染程度。现测得甲车间排放的污水呈碱性。则
、OH-中的四种。若各自单独排放会造成较大污染,如果混合后再排放,则会大大降低污染程度。现测得甲车间排放的污水呈碱性。则
 、SO
、SO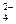
 、NO
、NO