题目内容
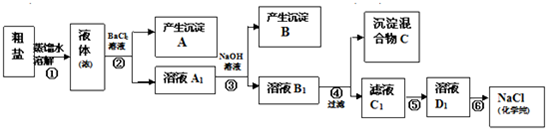
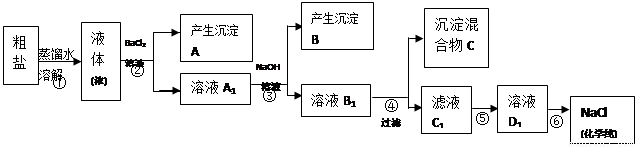
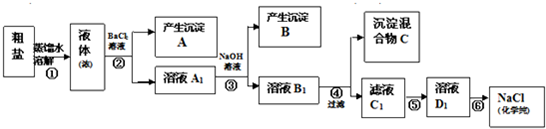
(12分)某校探究学习小组同学用含有少量杂质(主要为少量泥沙、CaCl2、MgCl2、Na2SO4等)的粗盐制取“化学纯”级的NaCl,实验前他们设计了如下方案(框图)。
(1)请写出操作第④、⑤步所加试剂名称及第⑥步操作名称:④ ,⑤ ,⑥ ;
(2) 沉淀混合物C的化学成分有(用文字和化学式表示): ;
(3)写出第⑤步操作中可能发生反应的离子方程式:
;
(4)如何用最简单方法检验第⑤步实验是否达到了目的:
;
(5)你认为该设计里哪些步骤调换后不影响实验结果: ;
(6)有同学认为上述实验设计步骤可以简化,请你提出简化的一种设想:
。
(12分)⑴④碳酸钠溶液 ⑤盐酸 ⑥蒸发(蒸发结晶也可)(各1分)
⑵泥沙、BaSO4、BaCO3、CaCO3、Mg(OH)2(2分)
⑶第⑤步:H+ + OH- = H2O (1分) CO32- + 2H+ = H2O + CO2↑(1分)
⑷用玻璃棒蘸取溶液点在pH试纸中部,若变红,说明溶液呈酸性,无OH-、CO32-存在;若变蓝,说明溶液仍呈碱性,有OH-、CO32-存在,需继续滴加盐酸至呈酸性。(2分)
⑸②和③或③和④(2分)
⑹用Ba (OH)2代替BaCl2和NaOH,使②③步合并为一步(1分)
解析试题分析:根据题意,(1)沉淀A是硫酸钡,溶液A1是CaCl2、MgCl2、BaCl2的混合溶液,沉淀B是氢氧化镁,溶液B1是CaCl2、NaOH、BaCl2的混合溶液,所以操作④应该加碳酸钠溶液除去CaCl2、BaCl2,沉淀C为碳酸钙与碳酸钡,溶液C1为NaOH、NaCl、NaCO3的混合溶液,所以⑤加盐酸。全部转化为氯化钠溶液,最后采取蒸发除掉多余的盐酸,并得到氯化钠固体。
(2)泥沙、BaSO4、BaCO3、CaCO3、Mg(OH)2
(3)第⑤步操作中发生盐酸与氢氧化钠反应的离子方程式:H+ + OH- = H2O
(4)利用酸碱中和反应原理,用玻璃棒蘸取溶液点在pH试纸中部,若变红,说明溶液呈酸性,无OH-、CO32-存在;若变蓝,说明溶液仍呈碱性,有OH-、CO32-存在,需继续滴加盐酸至呈酸性。
(5)②和③调换先除去SO42-与先除去Mg2+都不影响结果,
(6)用Ba (OH)2代替BaCl2和NaOH,使②③步合并为一步。
考点:物质的分离除杂。
点评:本题主要考查了在粗盐提纯中的物质的除杂或净化操作,在解此类题时,首先要了解需要除去的是哪些离子,然后选择适当的试剂进行除杂,在除杂质时,杂质和所加的试剂的状态一样,就要注意,加入的量的控制。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案