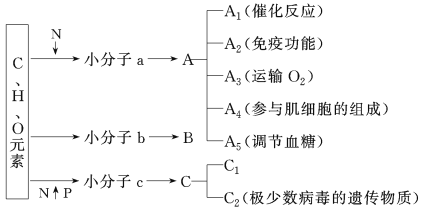
题目内容
【题目】现有常温条件下甲、乙、丙三种溶液,甲为0.1 mol/L的NaOH溶液,乙为0.1 mol/L的HCl溶液,丙为0.1 mol/L的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=__________;
(2)丙溶液中存在电离平衡为_____________、______________(用电离方程式表示);
(3)某同学用甲溶液分别滴定20.00 mL乙溶液和 20.00 mL丙溶液,得到如图所示两条滴定曲线,请完成有关问题:
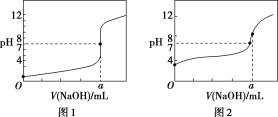
①甲溶液滴定丙溶液的曲线是________(填“图1”或“图2”);
②a=________。
【答案】13 CH3COOH ![]() CH3COO-+H+ H2O
CH3COO-+H+ H2O![]() OH-+H+ 图2 20.00
OH-+H+ 图2 20.00
【解析】
(1)0.1molL-1的NaOH溶液中c(OH-)=0.1mol/L,故根据水的离子积常数可知溶液中c(H+)=1×10-13mol/L,因此该溶液的pH=-lg10-13=13;
(2)0.1molL-1的CH3COOH溶液中存在溶剂水,水为弱电解质,溶质乙酸为弱电解质,因此存在电离平衡为CH3COOH![]() CH3COO-+H+、H2O
CH3COO-+H+、H2O![]() OH-+H+;
OH-+H+;
(3)①醋酸为弱电解质,滴定过程中pH变化较盐酸缓慢,滴定终点时溶液呈碱性,则滴定醋酸溶液的曲线是图2;
②滴定终点时n(CH3COOH)=n(NaOH),则a=20.00mL,反应生成了醋酸钠,醋酸根离子发生水解,CH3COO-+H2O![]() CH3COOH+OH-,溶液显示碱性pH>7。
CH3COOH+OH-,溶液显示碱性pH>7。

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目