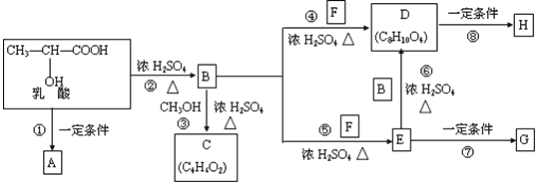
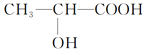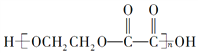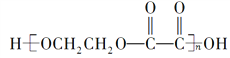��Ŀ����
����Ŀ����ҵ��������������������Ҫ�ɷ�ΪFe2O3��FeO��SiO2�ȣ�Ϊԭ���Ʊ��ߵ�������������(Fe2O3)�����������������£�

�Իش��������⣺
��1��������������ϡ��������ʱ�IJ�����Ϊ______________���ѧʽ����
��2��ʵ����ʵ�����������з���������õIJ���������______________��
��3�����鲽�����Ѿ�������ȫ���Լ���______________��
��4���������ķ�Ӧ�¶�һ���������35�����£���Ŀ����____________________________��
��5���������з�����Ӧ�Ļ�ѧ����ʽΪ______________��
��6�����ⶨ������������FeԪ�ص�������������ȡag��Ʒ�����������������ˮ��������ˣ�����Һ�м���������H2O2����ַ�Ӧ�����NaOH��Һ�����ټ������������������ˡ�ϴ�ӡ�������������أ���ȴ��Ƶò�������bg�� �������Ʒ��FeԪ�ص���������Ϊ______________��
���𰸡� SiO2 ©�������������ձ� KSCN��Һ(������������) ��ֹNH4HCO3�ֽ⣬����Fe2����ˮ�� 4FeCO3��O2![]() 2Fe2O3��4CO2
2Fe2O3��4CO2 ![]() ��100%
��100%
����������������������������������������������������˺�õ�������Ϊ�������裬��Һ�м���������ۣ���������������Һ������pH�����̼�������Һ��������̼���������壬��ϴ�ӡ�����ڿ���������ʱ�����ֽ⣬��������е���������������ԭ��Ӧ����������������
(1)����������(��Ҫ�ɷ�ΪFe3O4��Fe2O3��FeO��SiO2)�����ܹ�����Fe3O4��Fe2O3��FeO�������ܽ⣬����������������������Բ�����ΪSiO2���ʴ�Ϊ��SiO2��
(2)���ݷ�����֪�������Ϊ���ˣ����˲������õIJ���������©�������������ձ��ȣ��ʴ�Ϊ��©�������������ձ���
(3)������ǽ������ӻ�ԭ���������ӣ����鲽����Ѿ�������ȫ������Һ��û�������ӣ�������KSCN��Һ���ʴ�Ϊ��KSCN��Һ��
(4)������Ǽ���̼����鱗���̼�������������¶ȹ�����������ˮ��̶�����ͬʱ̼��������ֽ⣬�����¶�һ���������35�����£��ʴ�Ϊ����ֹNH4HCO3�ֽ⣬����Fe2+��ˮ�⣻
(5)������з�����ӦΪ̼�������ڿ���������������������ԭ��Ӧ������������������Ӧ����ʽΪ4FeCO3+O2![]() 2Fe2O3+4CO2���ʴ�Ϊ��4FeCO3+O2
2Fe2O3+4CO2���ʴ�Ϊ��4FeCO3+O2![]() 2Fe2O3+4CO2��
2Fe2O3+4CO2��
(6)�������⣬���Ƶò�������bgΪ������������Ԫ�ص�����Ϊ![]() ��bg=0.7bg��������Ԫ���غ��֪��Ʒ����Ԫ�ص�����Ϊ0.7bg��������Ʒ��FeԪ�ص���������Ϊ
��bg=0.7bg��������Ԫ���غ��֪��Ʒ����Ԫ�ص�����Ϊ0.7bg��������Ʒ��FeԪ�ص���������Ϊ![]() ��100%=
��100%=![]() ��100%���ʴ�Ϊ��
��100%���ʴ�Ϊ�� ![]() ��100%��
��100%��

 �������¿��ÿ�ʱ��ҵϵ�д�
�������¿��ÿ�ʱ��ҵϵ�д� Ӣ�żƻ�ͬ����ʱ��Чѵ��ϵ�д�
Ӣ�żƻ�ͬ����ʱ��Чѵ��ϵ�д�����Ŀ�����������������л������������ȷ����
ѡ�� | �л��� | ���� | ������ |
A |
| ���л����һ�ȴ��� | 4 |
B | C6H12O2 | ����NaHCO3��Һ��Ӧ | 3 |
C | C5H12O | ����2�����Ĵ� | 5 |
D | C5H10O2 | �����������»�ˮ�����ɼ��ң��Ҽס��ҵ���Է���������� | 4 |
A. A B. B C. C D. D