题目内容
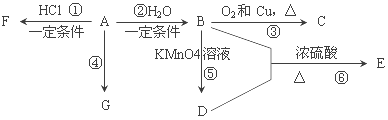
【题目】(8分)A、B、C、D、E、F、G为原子序数依次递增的7种短周期主族元素。A、B元素的最高正价与最低负价的代数和均为零;C元素是植物生长三大营养元素之一;D的单质具有强氧化性,D的氢化物形成的酸常用于雕刻玻璃;E原子核外K层电子数与M层电子数相等;F原子的价电子数等于电子层数的两倍。请回答下列问题 :
(1)CD3的电子式为______________;
(2)用离子方程式表示G的非金属性比F强______________;
(3)C与E形成的化合物溶解于水中的反应方程式为______________;
(4)C的氢化物与G的单质以物质的量之比1:3反应,生成二元化合物X和一种气体,该气体遇氨气产生“白烟”,则X的化学是为______________。
【答案】(1)![]() (2分);(2)Cl2+S2-=S↓+2Cl-(2分);
(2分);(2)Cl2+S2-=S↓+2Cl-(2分);
(3)Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑(2分); (4) NCl3(2分)。
【解析】试题分析:A、B、C、D、E、F、G为原子序数依次递增的7种短周期主族元素,D的单质具有强氧化性,且D的氢化物形成的酸常用于雕刻玻璃,则D为F元素;A、B元素的最高正价与最低负价的代数和均为零,A为H元素、B为C元素;C元素是植物生长三大营养元素之一,C为N元素;E原子核外K层电子数与M层电子数相等,E为Mg元素;F原子的价电子数等于电子层数的两倍,则F为S元素,则G为Cl元素。
(1)NF3分子中N原子与F原子之间形成对共用电子对,其电子式为![]() ;
;
(2)元素的非金属性越强,其单质的氧化性越强,氯气能和硫离子反应生成硫单质说明非金属性Cl>S,离子方程式为Cl2+S2-=S↓+2Cl-;
(3)氮化镁和水反应生成氢氧化镁和氨气,反应方程式为Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑;
(4)C的氢化物为氨气,与氯气以物质的量之比1:3反应,生成二元化合物X和一种气体,该气体遇氨气产生“白烟”,该气体为HCl,由原子守恒可知X为NCl3。