题目内容
已知稀硝酸与铜反应时,NO3-一般被还原为NO;浓硝酸与铜反应时,NO3-一般被还原为NO2.现将25.6g Cu投入到50mL 12mol/L的浓硝酸中,充分反应后,收集到4.48L(标况)NO和NO2的混合气体.
(1)被还原的硝酸的物质的量为:______.
(2)25.6g Cu与50mL 12mol/L的硝酸反应后,剩余物为:______,其物质的量为:______.
(3)容积为4.48L的干燥烧瓶充满上述反应中收集的NO和NO2的混合气体(标况)后倒置于水中,须再通入______L(标况)O2才能使溶液充满烧瓶.
(4)如果往反应后的体系内再加入200mL 4mol/L的稀硫酸,是否有气体逸出?若有,计算生成气体在标况下的体积(要求有简单过程,结果保留三位有效数字).
解:发生反应的方程式有:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O
n(Cu)= =0.4mol,n(HNO3)=0.05L×12mol/L=0.6mol,n(NO)+n(NO2)=
=0.4mol,n(HNO3)=0.05L×12mol/L=0.6mol,n(NO)+n(NO2)=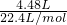 =0.2mol,
=0.2mol,
(1)根据N原子守恒可知,被还原的硝酸的物质的量等于生成NO和NO2的物质的量,
即n(NO)+n(NO2)=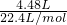 =0.2mol,故答案为:0.2mol;
=0.2mol,故答案为:0.2mol;
(2)设有amol Cu被氧化,则生成2amol Cu(NO3)2,
根据N元素守恒可知:n(Cu(NO3)2)+n(NO)+n(NO2)=0.6mol,
则有:2a+0.2=0.6,a=0.2,
即被氧化的Cu为0.2mol,则剩余0.4mol-0.2mol=0.2mol,
故答案为:Cu;0.2mol;
(3)由题意可知:HNO3

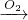 HNO3,
HNO3,
即0.2mol Cu失去0.4mol电子,O2得到0.4mol电子,需氧气0.1mol,即2.24L标态氧气,
故答案为:2.24;
(4)反应后溶液中含有n(NO3-)=0.4mol,
加入H+的物质的量为:n(H+)=2n(H2SO4)=2×0.2L×4mol/L=1.6mol,
剩余0.2mol Cu,
则:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
3 2 8 2
0.2mol 0.4mol 1.6mol n(NO)
由以上各物质的量可知,往反应后的体系内再加入200mL 4mol/L的稀硫酸,Cu完全反应,
生成n(NO)= =0.133mol,
=0.133mol,
V(NO)=0.133mol×22.4L/mol=2.99L,
答:生成气体在标况下的体积为2.99L.
分析:发生反应有:
Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O
25.6g Cu为0.4mol,全部反应失去0.8mol电子,如果4.48L气体(0.2mol)全部为NO,即得到了0.6mol电子,如果全部为NO2,则得到0.2mol电子,所以肯定是Cu过量.
(1)能够求得被还原的硝酸为0.2mol(即等于NO和NO2物质的量);
(2)设有amol Cu被氧化,根据硝酸守恒,有2a+0.2=0.6,即被氧化的Cu为0.2mol.剩余0.2mol.
(3)要使混合气体全部氧化,需要把硝酸得到的电子再转移给氧气,所以需要转移0.4mol电子,需氧气0.1mol,即2.24L标态氧气.
(4)根据3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O计算.
点评:本题考查硝酸与铜反应的有关计算,题目难度较大,注意有关反应方程式的书写,从质量守恒的角度解答.
3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O
n(Cu)=
 =0.4mol,n(HNO3)=0.05L×12mol/L=0.6mol,n(NO)+n(NO2)=
=0.4mol,n(HNO3)=0.05L×12mol/L=0.6mol,n(NO)+n(NO2)=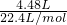 =0.2mol,
=0.2mol,(1)根据N原子守恒可知,被还原的硝酸的物质的量等于生成NO和NO2的物质的量,
即n(NO)+n(NO2)=
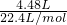 =0.2mol,故答案为:0.2mol;
=0.2mol,故答案为:0.2mol;(2)设有amol Cu被氧化,则生成2amol Cu(NO3)2,
根据N元素守恒可知:n(Cu(NO3)2)+n(NO)+n(NO2)=0.6mol,
则有:2a+0.2=0.6,a=0.2,
即被氧化的Cu为0.2mol,则剩余0.4mol-0.2mol=0.2mol,
故答案为:Cu;0.2mol;
(3)由题意可知:HNO3


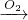 HNO3,
HNO3,即0.2mol Cu失去0.4mol电子,O2得到0.4mol电子,需氧气0.1mol,即2.24L标态氧气,
故答案为:2.24;
(4)反应后溶液中含有n(NO3-)=0.4mol,
加入H+的物质的量为:n(H+)=2n(H2SO4)=2×0.2L×4mol/L=1.6mol,
剩余0.2mol Cu,
则:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
3 2 8 2
0.2mol 0.4mol 1.6mol n(NO)
由以上各物质的量可知,往反应后的体系内再加入200mL 4mol/L的稀硫酸,Cu完全反应,
生成n(NO)=
 =0.133mol,
=0.133mol,V(NO)=0.133mol×22.4L/mol=2.99L,
答:生成气体在标况下的体积为2.99L.
分析:发生反应有:
Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O
25.6g Cu为0.4mol,全部反应失去0.8mol电子,如果4.48L气体(0.2mol)全部为NO,即得到了0.6mol电子,如果全部为NO2,则得到0.2mol电子,所以肯定是Cu过量.
(1)能够求得被还原的硝酸为0.2mol(即等于NO和NO2物质的量);
(2)设有amol Cu被氧化,根据硝酸守恒,有2a+0.2=0.6,即被氧化的Cu为0.2mol.剩余0.2mol.
(3)要使混合气体全部氧化,需要把硝酸得到的电子再转移给氧气,所以需要转移0.4mol电子,需氧气0.1mol,即2.24L标态氧气.
(4)根据3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O计算.
点评:本题考查硝酸与铜反应的有关计算,题目难度较大,注意有关反应方程式的书写,从质量守恒的角度解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目