题目内容
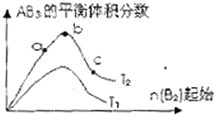 某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB2(g)化学平衡状态的影响,得到如右图所示的变化规律(图中T表示温度,n表示物质的量),据此可得出的判断结论不正确的是( )
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB2(g)化学平衡状态的影响,得到如右图所示的变化规律(图中T表示温度,n表示物质的量),据此可得出的判断结论不正确的是( )| A、达到平衡时A2的转化率大小为:b>a | B、a、b、c三点的平衡常数相同 | C、若T2>T1,则正反应一定是吸热反应 | D、b点时,平衡体系中A、B原子数之比一定是1:1 |
分析:由图可知,B2起始相同时,T2对应的AB3的含量大,则若该正反应为吸热反应,则T2>T1,若该正反应为放热反应,则T2<T1;由图可知B2越大,达到平衡时A2的转化率越大,且b点AB3的体积分数最大,则反应物的物质的量之比接近等于化学计量数之比,以此来解答.
解答:解:A.由图可知,横坐标为B2的物质的量,增大一种反应物的量必然会促进另一种反应物的转化,则B2越大达到平衡时A2的转化率越大,即达到平衡时A2的转化率大小为b>a,故A正确;
B.a、b、c三点为同一温度下的平衡,温度相同,平衡常数相同,所以a、b、c三点的平衡常数相同,故B正确;
C.由图可知,B2起始相同时,T2对应的AB3的含量大,则若该正反应为吸热反应,则T2>T1,若该正反应为放热反应,则T2<T1,故C正确;
D.b点AB3的体积分数最大,则反应物的物质的量之比接近等于化学计量数之比,反应物均为双原子分子,所以平衡体系中A、B原子数之比接近1:3,故D错误;
故选D.
B.a、b、c三点为同一温度下的平衡,温度相同,平衡常数相同,所以a、b、c三点的平衡常数相同,故B正确;
C.由图可知,B2起始相同时,T2对应的AB3的含量大,则若该正反应为吸热反应,则T2>T1,若该正反应为放热反应,则T2<T1,故C正确;
D.b点AB3的体积分数最大,则反应物的物质的量之比接近等于化学计量数之比,反应物均为双原子分子,所以平衡体系中A、B原子数之比接近1:3,故D错误;
故选D.
点评:本题考查化学反应速率及化学平衡图象,明确横坐标为反应物B2的物质的量及该反应可能为吸热反应,也可能为放热反应是解答本题的关键,题目难度较大,为易错题.

练习册系列答案
 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
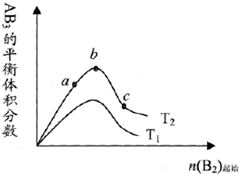 某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度)由此可得出的结论是( )
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度)由此可得出的结论是( )| A、反应速率a>b>c | B、达到平衡时A2的转化率大小为:b>a>c | C、若T2>T1,则正反应一定是吸热反应 | D、达到平衡时,AB3的物质的量大小为:c>b>a |
某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
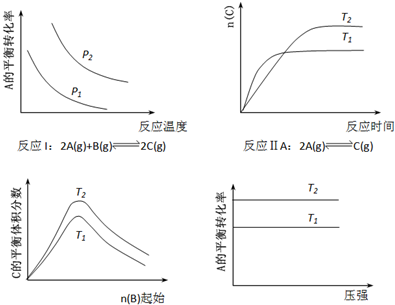
根据以上规律判断,下列结论正确的是( )

根据以上规律判断,下列结论正确的是( )
| A、反应Ⅰ:△H>0,P2>P1 | B、反应Ⅱ:△H<0,T1<T2 | C、反应Ⅲ:△H>0,T2>T1或△H<0,T2<T1 | D、反应Ⅳ:△H<0,T2>T1 |
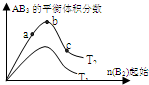 (2009?浙江模拟)某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的是( )
(2009?浙江模拟)某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的是( )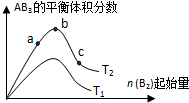 某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是( )
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是( )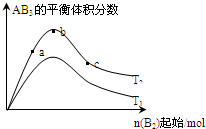 某化学科研小组研究在其它条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响时,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据图示得出的结论中正确的是( )
某化学科研小组研究在其它条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响时,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据图示得出的结论中正确的是( )