题目内容
下列实验操作不正确的是( )
①向盛有20mL沸腾蒸馏水的烧杯中滴加1mL~2mLFeCl3饱和溶液.继续煮沸至溶液呈红褐色,得Fe(OH)3胶体
②配制FeCl3溶液时,将一定量氯化铁溶解在少量较浓的盐酸中,再用蒸馏水稀释到所需浓度
③将氢氧化钠固体放在滤纸上称量
④为减小中和滴定误差,锥形瓶必须洗净并烘干后才能使用.
①向盛有20mL沸腾蒸馏水的烧杯中滴加1mL~2mLFeCl3饱和溶液.继续煮沸至溶液呈红褐色,得Fe(OH)3胶体
②配制FeCl3溶液时,将一定量氯化铁溶解在少量较浓的盐酸中,再用蒸馏水稀释到所需浓度
③将氢氧化钠固体放在滤纸上称量
④为减小中和滴定误差,锥形瓶必须洗净并烘干后才能使用.
分析:①将饱和三氯化铁溶液滴人沸蒸馏水中来制取氢氧化铁胶体;
②氯化铁易水解;
③氢氧化钠有腐蚀性,易潮解;
④锥形瓶中的水不影响酸碱的含量.
②氯化铁易水解;
③氢氧化钠有腐蚀性,易潮解;
④锥形瓶中的水不影响酸碱的含量.
解答:解:①用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,然后将饱和三氯化铁溶液滴入沸水中,并继续煮沸至液体呈透明的红褐色即得氢氧化铁胶体,故①正确;
②氯化铁在水溶液中由于水解会呈酸性,将氯化铁溶解在盐酸中,可以抑制铁离子的水解,故②正确;
③氢氧化钠有腐蚀性,易潮解,要放在玻璃器皿中称量,故③错误;
④锥形瓶中的水不影响酸碱的含量,无误差,故④错误;
故选C.
②氯化铁在水溶液中由于水解会呈酸性,将氯化铁溶解在盐酸中,可以抑制铁离子的水解,故②正确;
③氢氧化钠有腐蚀性,易潮解,要放在玻璃器皿中称量,故③错误;
④锥形瓶中的水不影响酸碱的含量,无误差,故④错误;
故选C.
点评:本题考查化学实验方案的评价,题目难度不大,本题注意把握相关物质的性质,为解答该题的关键.

练习册系列答案
相关题目
下列实验操作不正确的是( )
| A、用酒精灯加热试管里的固体时先预热 | B、在稀释浓硫酸时,将水沿器壁慢慢注入浓硫酸里,并用玻璃棒搅拌 | C、气体发生装置在盛装药品前需检验装置的气密性 | D、称量氢氧化钠固体时用小烧杯盛装 |
下列实验操作不正确的是( )
A、 定容 | B、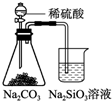 比较硫、碳、硅三种元素的非金属性强弱 | C、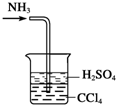 处理尾气 | D、 测定黄铜(Cu、Zn合金) 中Zn的含量 |