题目内容
下列说法中正确的是
| A.干冰、液态氯化氢都是电解质 |
| B.Na2O2晶体中既含有离子键又含有共价键 |
| C.Na2O、Fe2O3、Al2O3既属于碱性氧化物,又属于离子化合物 |
| D.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
B
解析试题分析:A、溶于水或在熔融状态下能够自身电离出离子的化合物是电解质,溶于水和在熔融状态下不能自身电离出离子的化合物是非电解质。干冰是CO2,属于非电解质。液态氯化氢是电解质,A不正确;B、Na2O2的电子式为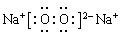 ,因此晶体中既含有离子键又含有共价键,B正确;C、能和酸反应生成盐和水的氧化物是碱性氧化物,Na2O、Fe2O3属于碱性氧化物。氧化铝既能和酸反应生成盐和水,也能和碱反应生成盐和水,属于两性氧化物,C不正确;D、三种分散系的本质区别是分散质离子的直径大小不同,而不是丁达尔效应,D不正确,答案选B。
,因此晶体中既含有离子键又含有共价键,B正确;C、能和酸反应生成盐和水的氧化物是碱性氧化物,Na2O、Fe2O3属于碱性氧化物。氧化铝既能和酸反应生成盐和水,也能和碱反应生成盐和水,属于两性氧化物,C不正确;D、三种分散系的本质区别是分散质离子的直径大小不同,而不是丁达尔效应,D不正确,答案选B。
考点:考查电解质、化学键、碱性氧化物以及分散系的判断

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
FeCl3溶液、Fe(OH)3胶体共同具备的性质是
| A.都呈透明的红褐色 |
| B.分散质颗粒直径相同 |
| C.都比较稳定,密封保存一段时间都不会产生沉淀 |
| D.都能产生丁达尔现象 |
分类法是一种简单易行、行之有效的科学方法。碳酸钠不属于
| A.纯净物 | B.化合物 | C.氧化物 | D.盐 |
已知Ca(OH)2的溶解度随温度升高而降低。将40℃的饱和澄清石灰水冷却至l0℃,或保持40℃向其中加入少量CaO,两种情况下均保持不变的是
| A.溶液中Ca2+的数目 |
| B.溶剂的质量 |
| C.溶液中溶质的物质的量浓度 |
| D.溶质的质量 |
下列物质属于纯净物的是
| A.冰水混合物 | B.爆鸣气 | C.天然气 | D.纯净的无污染的空气 |
下列各组物质,按化合物、单质、混合物顺序排列的是
| A.生石灰、白磷、冰水混合物 | B.烧碱、液氧、碘酒 |
| C.干冰、铁、氯化氢 | D.纯碱、氮气、胆矾 |
一般情况下胶体稳定,胶体微粒不易聚集,主要原因是( )
| A.胶体有丁达尔现象 |
| B.胶体有布朗运动 |
| C.胶体微粒因吸附带电荷离子而带电,带同种电荷的微粒间相互排斥 |
| D.胶体微粒直径在1~100nm之间,微粒小,不受重力作用 |
下列关于胶体的叙述不正确的是( )
| A.胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9 m~ 10-7m之间 |
| B.光线透过胶体时,胶体中可发生丁达尔效应 |
| C.用聚光手电筒照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同 |
| D.Fe(OH)3胶体能够吸附水中悬浮的固体颗粒并沉降,达到净水目的 |
下列说法正确的是
| A.16O和18O互为同位素 | B.漂粉精、液氯、干冰均为混合物 |
| C.稀硫酸、氨水均为电解质 | D.溶于水能电离出H+ 的物质一定是酸 |