题目内容
常温下,对下列电解质溶液的有关说法一定正确的是( )
| A.相同浓度和体积的强碱和强酸溶液混合后,溶液的pH=7 |
| B.在NaHCO3溶液中,c(CO32—)>c(HCO3—) |
| C.在有AgCl沉淀的溶液中加入NaCl固体,c(Ag+)减小 |
| D.将pH相等的CH3COONa和Na2CO3溶液稀释相同倍数,CH3COONa溶液的pH较大 |
C
解析

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.6×10-9。该温度下,下列说法不正确的是
| A.同浓度的Na2SO4和Na2CO3混合溶液中滴加BaCl2溶液,BaSO4先析出 |
| B.BaCO3的悬浊液中加入少量的新制氯水,c(Ba2+)增大 |
C.BaSO4和BaCO3共存的悬浊液中,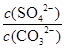 = = |
| D.BaSO4悬浊液中加入Na2CO3浓溶液,BaSO4不可能转化为BaCO3 |
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示。下列判断正确的是
| A.a、c两点溶液的导电能力相同 |
| B.a、b、c三点溶液水的电离程度a>b>c |
C.b点溶液中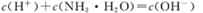 |
| D.用等浓度NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液体积Vb =Vc。 |
某pH=1的ZnCl2和HCl的混合溶液中含有FeCl3杂质,通过水解除去杂质,需将溶液调至pH=4,在调节溶液pH时,应选用的试剂是
| A.NaOH | B.ZnO | C.Na2CO3 | D.Fe2O3 |
已知如下物质的溶度积常数:FeS:Ksp=6.3×10-18;CuS:Ksp=1.3×10-36;ZnS:Ksp=1.6×10-24。下列说法正确的是( )
| A.同温度下,CuS的溶解度大于ZnS的溶解度 |
| B.将足量CuSO4溶解在0.1 mol·L-1的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35 mol·L-1 |
| C.因为H2SO4是强酸,故CuSO4+H2S=CuS↓+H2SO4不能发生 |
| D.除去工业废水中的Cu2+,可以选用FeS作沉淀剂 |
能说明0.1 mol·L-1的NaHA溶液一定呈酸性的是( )
①稀释时,溶液中c(OH-)增大
②溶液的pH<7
③溶液中c(Na+)=c(A2-)
④溶液可与等体积等物质的量浓度的NaOH溶液恰好反应
| A.①②③④ | B.①③④ | C.①③ | D.②④ |
化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)??CuS(s)+Mn2+(aq),下列说法错误的是( )
| A.MnS的Ksp比CuS的Ksp大 |
| B.该反应达平衡时c(Mn2+)=c(Cu2+) |
| C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 |
D.该反应的平衡常数K= |
部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡 常数(25℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
下列选项正确的是( )。
A.2CN-+H2O+CO2=2HCN+CO32-
B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.等浓度的HCOONa和NaCN溶液的pH前者大于后者
D.中和等浓度的HCOOH和HCN消耗NaOH的量前者等于后者