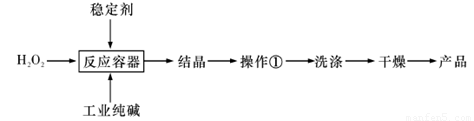
题目内容
某校化学课外小组用硫酸铁废液(含少量硫酸铜和稀硫酸),制备硫酸亚铁晶体并进行如下实验。制备硫酸亚铁晶体主要的操作流程如下:

请根据题目要求回答下列问题:
(1)A的化学式为 ,上述操作过程中用到的玻璃仪器有:①烧杯、②③玻璃棒、③酒精灯、④温度计、⑤ 。
(2)趁热过滤的目的是 。
(3)结晶操作过程中应控制滤液酸性的原因是____
(4)已知硫酸亚铁铵[(NH4)2Fe (SO4)2]比硫酸亚铁稳定,用在分析化学中。硫酸亚铁铵可用硫酸铵和硫酸亚铁反应制得。实验室利用硫酸亚铁铵溶液和草酸溶液反应生成草酸亚铁沉淀来制备草酸亚铁。写出硫酸亚铁铵溶液与草酸溶液反应的离子方程式____ 。
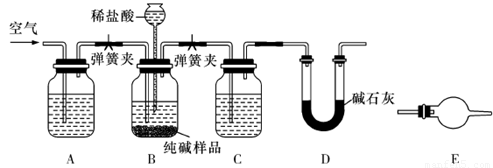
(5)草酸亚铁晶体(相对分子质量180)受热易分解,某课外小组设计如图的实验装置来检验其分解产物。

①该装置中最不合理的部分 (填字母),原因是 。
②改用正确装置实验开始后,B处变蓝,说明草酸亚铁晶体中有 ;C处有白色沉淀,E处部分黑色粉末变为红色,说明草酸亚铁分解产生 (填化学式)。
(1)Fe 1分,漏斗 1分
(2)防止硫酸亚铁晶体析出 1分
(3)防止Fe2+水解1分
(4) Fe2++H2C2O4→FeC2O4 ↓ +2H+ 2分
(5)①A 1分;试管口向上,反应生成的水倒流入试管会使试管破裂,故试管口应略向下 2分
②结晶水 1分 ,CO2、CO 2分
解析:
略

练习册系列答案
相关题目