题目内容
【题目】利用X射线对BaSO4穿透能力较差的特性,医学上在进行消化系统的X射线透视时,常用BaSO4作内服造影剂,这种检查手段成为钡餐透视。
(1)医学上进行钡餐透视时为什么不用BaCO3的理由是________ (用离子方程式表示)。
(2)某课外活动小组为了探究BaSO4的溶解度,分别将足量BaSO4放入:
A.5 mL水;
B.40 mL 0.2 molL-1的Ba(OH)2溶液;
C.20 mL 0.5 molL-1的Na2SO4溶液;
D.40 mL 0.1 molL-1的H2SO4溶液中。
①溶解BaSO4后形成的溶液中,Ba2+|的浓度由大到小的顺序为________(填字母)。
A.b>a>c>d B.b>a>d>c C.a>d>c>b D.a>b>d>c
②已知298 K时,Ksp(BaSO4)=1.1×10-10,上述条件下,溶液b中加入BaSO4后,c(SO42-)为__________ molL-1,溶液c中加入BaSO4后,c(Ba2+)为__________ molL-1。
③常温下,若将溶液b和溶液d直接混合,则混合液的pH为__________(设混合溶液的体积为混合前两溶液的体积之和)。
【答案】(1)BaCO3+2H+=Ba2++CO2↑+H2O
(2)①B②5.5×10-10;2.2×10-10③13
【解析】
试题分析:(1)硫酸钡不溶于水和酸,但胃酸可与CO32-反应生成水和二氧化碳,使CO32-浓度降低,从而使平衡BaCO3(s)Ba2+(aq)+CO32-(aq) 向溶解方向移动,使Ba2+浓度增大,且Ba2+有毒,所以不能用碳酸钡代替硫酸钡,反应离子方程式为:BaCO3+2H+═Ba2++H2O+CO2↑;(2)①根据难溶电解质的溶度积常数知,溶液中硫酸根离子浓度越大,硫酸钡的溶解度越小,钡离子浓度越低,氢氧化钡能抑制硫酸钡的电离,但氢氧化钡溶液中含有钡离子,所以钡离子浓度最大;水中的钡离子浓度次之;硫酸钠溶液和硫酸溶液中都含有硫酸根离子,抑制硫酸钡的电离,硫酸钠中的硫酸根浓度大于硫酸中的浓度,所以硫酸钠溶液中钡离子的浓度小于硫酸溶液中钡离子浓度,所以钡离子浓度大小顺序是:b>a>d>c,故选B;②中C(SO4 2-)=![]() mol/L=5.5×10-10mol/L,③中C(Ba2+)=
mol/L=5.5×10-10mol/L,③中C(Ba2+)=![]() mol/L=2.2×10-10mol/L;40ml 0.2molL-1的Ba(OH)2溶液和40ml 0.1molL-1的H2SO4溶液中混合后溶液中C(OH-)=
mol/L=2.2×10-10mol/L;40ml 0.2molL-1的Ba(OH)2溶液和40ml 0.1molL-1的H2SO4溶液中混合后溶液中C(OH-)=![]() =0.1mol/L,则C(H+)=10-13 mol/L,所以pH=13。
=0.1mol/L,则C(H+)=10-13 mol/L,所以pH=13。

【题目】某课外兴趣小组进行电解原理的实验探究,做了如下的实验:以铜为电极,按如图所示的装置电解饱和食盐水。
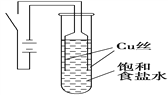
实验现象:接通电源30 s内,阳极附近出现白色浑浊,之后变成橙黄色浑浊,此时测定溶液的pH约为10。一段时间后,试管底部聚集大量红色沉淀,溶液仍为无色。
查阅资料:
物质 | 氯化铜 | 氧化亚铜 | 氢氧化亚铜(不稳定) | 氯化亚铜 |
颜色 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 红色 | 橙黄色 | 白色 |
※ 相同温度下CuCl的溶解度大于CuOH。
下列说法错误的是( )
A. 反应结束后最终溶液呈碱性 B. 阴极上发生的电极反应为:2H2O + 2e- == H2↑+ 2OH-
C. 电解过程中氯离子移向阳极 D. 试管底部红色的固体具有还原性
【题目】某同学在实验室进行铁盐与亚铁盐相互转化的实验:
实验Ⅰ:将Fe3+转化为Fe2+
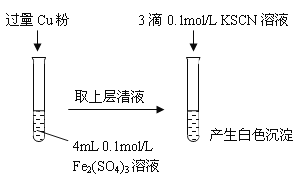
(1)Fe3+与Cu粉发生反应的离子方程式为______________________________。
(2)探究白色沉淀产生的原因,请填写实验方案:
实验方案 | 现象 | 结论 |
步骤1:取4mL_______mol/L CuSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 产生白色沉淀 | CuSO4与KSCN反应产生了白色沉淀 |
步骤2:取_____________________________ | 无明显现象 |
查阅资料:ⅰ. SCN-的化学性质与I-相似 ⅱ. 2Cu2+ + 4 I-= 2CuI↓+ I2
Cu2+与SCN-反应的离子方程式为_____________________________________。
实验Ⅱ:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL 0.1mol/L FeSO4溶液中加入1 mL 8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2+ + NO ![]() Fe(NO)2+(棕色),3Fe2+ +2[Fe(CN)6]3-= Fe3[Fe(CN)6]2(蓝色)
Fe(NO)2+(棕色),3Fe2+ +2[Fe(CN)6]3-= Fe3[Fe(CN)6]2(蓝色)
(3)用离子方程式解释NO 产生的原因_________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应; 反应Ⅱ:Fe2+与NO反应
①依据实验现象,甲认为反应Ⅰ的速率比反应Ⅱ__________(填“快”或“慢”)。
②乙认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是__________________________________________________________________________。
③已知:在一个已经达到平衡的可逆反应中,如果改变影响平衡的条件之一(如温度、压强,以及参加反应的化学物质的浓度),平衡将向着能够减弱这种改变的方向移动。如:当增加反应物的浓度时,平衡要向正反应方向移动,平衡的移动使得增加的反应物浓度又会逐步减少。
请用上述原理解释溶液由棕色变为黄色的原因________________________________。

