题目内容
五颜六色的颜色变化增添了化学的魅力,对下列有关反应的颜色叙述正确的是
①新制氯水久置后→浅黄绿色消失;
②淀粉溶液遇碘单质→蓝色;
③氯化铁溶液滴入甲苯中→紫色;
④热的黑色氧化铜遇乙醇→红色
| A.①③④ | B.①②④ | C.②③④ | D.①②③④ |
B
解析试题分析:①新制氯水久置后→浅黄绿色消失,是因为次氯酸分解促使氯气与水反应,所以黄绿色消失,正确;②淀粉溶液遇碘单质→蓝色,这是碘与淀粉的性质,正确;③氯化铁溶液滴入甲苯中→紫色,甲苯 不存在酚羟基,溶液不会呈紫色,错误;④热的黑色氧化铜遇乙醇→红色,这是乙醇与氧化铜发生氧化反应,生成乙醛和铜单质,所以固体黑色变红色,正确,答案选B。
考点:考查溶液颜色变化的反应原理

练习册系列答案
相关题目
下列实验的现象与对应结论均正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 将Cl2通入KI溶液 | 溶液变蓝色 | I-的还原性强于Cl- |
| B | 常温下将Fe片放入浓硫酸中 | 无明显变化 | 可以用铁槽车装运浓硫酸 |
| C | 将一小块Na放入硫酸铜溶液中 | 有红固体析出 | Na的活泼性强于铜 |
| D | 向AgCl浊液中滴加Na2S溶液 | 黑色沉淀生成 | Ksp(AgCl)>Ksp(Ag2S) |
某固体物质和某溶液在一定条件下反应,产生气体的相对分子质量(或平均相对分子质量)为45,则发生反应的物质不可能是
| A.Zn和浓H2SO4 | B.C和浓HNO3 | C.Na2O2和NH4Cl浓溶液 | D.Cu和浓HNO3 |
下表为各物质中所含的杂质以及除去这些杂质选用的试剂或操作方法,正确的是
| | 物质 | 杂质 | 试剂或方法 |
| A | NaHCO3溶液 | Na2CO3 | 通入过量的CO2 |
| B | FeCl3溶液 | CuCl2 | Fe |
| C | Fe2O3 | Al2O3 | 盐酸 |
| D | 碘水 | Br2 | 乙醇、萃取 |
下列实验“操作和现象”与“结论”对应关系正确的是
| | 操作和现象 | 结论 |
| A | 常温下将Al片放入浓硝酸中,无明显变化 | Al与浓硝酸不反应 |
| B | 向0.1mol·L-1 Na2CO3溶液中,滴加2滴酚酞显浅红色,微热, 红色加深。 | 说明盐类水解是吸热反应 |
| C | 向FeCl3溶液加入足量的铜粉,充分反应,静置,取上层清液 滴加几滴KSCN溶液,溶液不变血红色。 | 说明氧化性:Fe3+>Cu2+ |
| D | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
现有H2SO4、Ba(OH)2、Na2CO3和氯水4种溶液,有如图所示的相互关系,图中每条线段两端的物质可以发生化学反应。下列推断合理的是
| A.M一定是Ba(OH)2 |
| B.Y可能是氯水 |
| C.X一定是Na2CO3溶液 |
| D.Z可能是H2SO4 |
下列说法不正确的是
| A.新制氯水可使蓝色石蕊试纸先变红后褪色 |
| B.浓硝酸在光照下发黄,说明浓硝酸不稳定 |
| C.SO2、NO2分别与水发生的反应均为氧化还原反应 |
| D.水泥、普通玻璃、陶瓷等都是传统的硅酸盐制品 |
根据下列实验现象,所得结论正确的是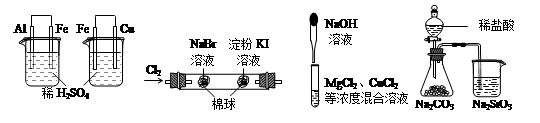
A B C D
| 实验 | 实验现象 | 结论 |
| A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
| B | 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C | 先生成蓝色沉淀,后产生白色沉淀 | 溶度积常数:Mg(OH)2<Cu(OH)2 Cu(OH)2Mg(OH)2<Cu(OH)2MgMg(OH)2<Cu(OH)2Mg(OH)2<Cu(OH)2 |
| D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
如图装置可用于收集气体并验证其某些化学性质,正确的是( )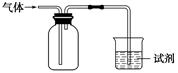
| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | NH3 | 酚酞试液 | 溶液变红色 | NH3的水溶液显碱性 |
| B | Cl2 | 紫色石蕊试液 | 溶液先变 红后褪色 | Cl2有酸性和漂白性 |
| C | C2H2 | 溴水 | 溶液褪色 | C2H2分子中含碳碳双键 |
| D | X | KI淀粉溶液 | 溶液变蓝 | X可能是Cl2或NO2 |