��Ŀ����
����Ŀ��NO2 ѹ���� N2O4 �������ȼ���е���������Ҳ�� �Ʊ������Լ� N2O5 �ȡ�
(1)���ȼ��ȼ�շ�Ӧ���£�2N2H4(l)��N2O4(l)��3N2(g)��4H2O(l)���� 1.00 g N2H4(l)������ N2O4(l)��ȫ��Ӧ���� N2(g)�� H2O(l)���ų� 19.14 kJ ����������÷�Ӧ�ġ�H��___________kJ/mol��
(2)�� 2 L �ܱ������ڣ�Ͷ��һ���� NO2���������з�Ӧ�� 2NO2(g) ![]() 2NO(g)+O2(g)�������ֲ�ͬ�������½���ʵ�飬NO2 ��Ũ����ʱ��ı仯��ͼ��ʾ����ش��������⣺
2NO(g)+O2(g)�������ֲ�ͬ�������½���ʵ�飬NO2 ��Ũ����ʱ��ı仯��ͼ��ʾ����ش��������⣺
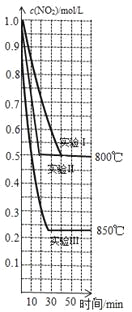
�ٲ���˵���÷�Ӧ�Ѵﵽƽ��״̬����___________________(����ĸ)��
a��v ��(NO2)=2v ��(O2)
b��c(NO2)= c(NO)
c��������ѹ����
d��NO ������������ֲ���
������˵����ȷ����___________________(����ĸ)��
a������ʵ�鿪ʼͶ��� NO2 �����ʵ�����Ϊ 1.0 mol
b��ʵ����ʵ�����ȣ����������������ǣ�ʵ���ʹ����Ч�ʸ��ߵĴ���
c���÷�Ӧ�Ƿ��ȷ�Ӧ
d��ʵ��������·�Ӧ��ƽ�ⳣ������ʵ��������·�Ӧ��ƽ�ⳣ��
e��800��ʱ���÷�Ӧ��ƽ�ⳣ��Ϊ 0.25
f���÷�Ӧ�ġ�S��0���ʸ÷�Ӧһ�����Է���Ӧ
��ʵ���ӷ�Ӧ��ʼ���մﵽƽ��ʱ��v(O2)=_________ mol/(L��min)
������� 2 L �ܱ�������ͨ�� 1 mol NO2��1 mol NO��0.5 mol O2����ƽ�⽫ �ƶ�(����ҡ�����������)��

(3)���� NO2 �� N2O4 ���Ʊ� N2O5��ԭ������ͼ��ʾ��N2O5 �ڵ��ص� ________(���������������)�����ɣ���缫��ӦʽΪ___________________��
���𰸡�
(1)-1224.96��
(2)��b����be����0.0125mol/(L��min)������
(3)������N2O4+2HNO3-2e-=2N2O5+2H+��
��������
���������(1)1.00g N2H4��ȫ��Ӧ�ų�19.14kJ����������2molN2H4��Ӧ�ų�������Ϊ19.14kJ��![]() =1224.96kJ���ʸ÷�Ӧ�ġ�H=-1224.96kJ/mol���ʴ�Ϊ��-1224.96��
=1224.96kJ���ʸ÷�Ӧ�ġ�H=-1224.96kJ/mol���ʴ�Ϊ��-1224.96��
(2)��a������v��(NO2)=2v��(O2)����v��(NO2)=2v��(O2)����v��(NO2)=v��(NO2)����Ӧ����ƽ��״̬����a��ѡ��b��ƽ��ʱc(NO2)��c(NO)Ũ�������������ת�����йأ�ƽ��ʱŨ�Ȳ�һ����ȣ���bѡ��c���淴Ӧ���У�ѹǿ����������ѹ����˵������ƽ�⣬��c��ѡ��d��������NO������������䣬˵����Ӧ����ƽ�⣬��d��ѡ����ѡ��b��
��a������ʵ�鿪ʼNO2�����ʵ���Ũ�Ⱦ�Ϊ1mol/L����ʼͶ���NO2�����ʵ�����Ϊ1mol/L��2L=2.0mol����a����b��ʵ����ʵ�����ȣ���Ӧ���ʼӿ죬ƽ��ʱ����������Ũ����ȣ���Ӱ��ƽ���ƶ��������������¶Ȼ�����ѹǿ��ʵ������ʹ����Ч�ʸ��ߵĴ�������b��ȷ��c�������¶ȣ�ƽ��ʱ����������Ũ�ȼ�С��˵�������¶�ƽ��������Ӧ�ƶ����������¶�ƽ�������ȷ�Ӧ�ƶ���������ӦΪ���ȷ�Ӧ����c����d�������¶�ƽ��������Ӧ�ƶ���ƽ�ⳣ������ʵ��������·�Ӧ��ƽ�ⳣ��С��ʵ��������·�Ӧ��ƽ�ⳣ������d����e��800��ʱ��ƽ��ʱ����������Ũ��Ϊ0.5mol/L����
2NO2(g)2NO(g)+O2(g)
��ʼ��(mol/L)��1 0 0
�仯��(mol/L)��0.5 0.5 0.25
ƽ����(mol/L)��0.5 0.5 0.25
800��ʱƽ�ⳣ��K= =
=![]() =0.25����e��ȷ��f�������¶�ƽ��������Ӧ�ƶ�������ӦΪ���ȷ�Ӧ����H��0������ӦΪ�����ķ�Ӧ������G=��H-T��S��0��Ӧ�Է����У�Ӧ�ڸ����¾����Է��ԣ���f����ѡ��be��
=0.25����e��ȷ��f�������¶�ƽ��������Ӧ�ƶ�������ӦΪ���ȷ�Ӧ����H��0������ӦΪ�����ķ�Ӧ������G=��H-T��S��0��Ӧ�Է����У�Ӧ�ڸ����¾����Է��ԣ���f����ѡ��be��
��v(NO2)=![]() =0.025mol/(L��min)������֮�ȵ��ڻ�ѧ������֮�ȣ�v(O2)=
=0.025mol/(L��min)������֮�ȵ��ڻ�ѧ������֮�ȣ�v(O2)=![]() v(NO2)=0.0125mol/(L��min)��Ũ����Qc=
v(NO2)=0.0125mol/(L��min)��Ũ����Qc= =0.5��K=0.25����Ӧ���淴Ӧ���У��ʴ�Ϊ��0.0125mol/(L��min)������
=0.5��K=0.25����Ӧ���淴Ӧ���У��ʴ�Ϊ��0.0125mol/(L��min)������
(3)����NO2��N2O4���Ʊ�N2O5��NԪ�ط���������Ӧ����N2O5�ڵ��ص����������ɣ���ͼ��֪���������� N2O4ʧȥ���ӣ���HNO3����������N2O5�����ݵ���غ��֪��H+���ɣ��缫��ӦʽΪ��N2O4+2HNO3-2e-=2N2O5+2H+���ʴ�Ϊ��������N2O4+2HNO3-2e-=2N2O5+2H+��

