题目内容
利用碱性氧化性溶液的氧化作用,在钢铁表面形成一层深蓝色的Fe3O4(也可表示为FeFe2O4)薄膜,保护内部金属免受腐蚀,这种方法叫做烤蓝.烤蓝时发生如下反应:
①3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
②Na2FeO2+NaNO2+H2O-Na2Fe2O4+NH3↑+NaOH(未配平)
③Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH
下列说法中正确的是( )
①3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
②Na2FeO2+NaNO2+H2O-Na2Fe2O4+NH3↑+NaOH(未配平)
③Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH
下列说法中正确的是( )
分析:A.根据氧化物及盐的概念,结合其可表示为FeFe2O4来分析;
B.根据电子守恒来分析;
C.反应③中各元素的化合价不变;
D.①②中存在元素的化合价变化,③中没有元素的化合价变化.
B.根据电子守恒来分析;
C.反应③中各元素的化合价不变;
D.①②中存在元素的化合价变化,③中没有元素的化合价变化.
解答:解:A.氧化物中只有两种元素,其一为氧元素,则属于氧化物,可表示为FeFe2O4,由金属阳离子与酸根离子构成,则属于盐,故A正确;
B.Fe元素由+2升高为+3,N元素由+3降低为-3,由电子守恒及质量守恒定律可知反应为6Na2FeO2+NaNO2+5H2O=3Na2Fe2O4+NH3↑+7NaOH,H2O的化学计量数为5,故B错误;
C.反应③中各元素的化合价不变,不属于氧化还原反应,故C错误;
D.①②中存在元素的化合价变化,③中没有元素的化合价变化,则以上三个反应不都是氧化还原反应,故D错误;
故选A.
B.Fe元素由+2升高为+3,N元素由+3降低为-3,由电子守恒及质量守恒定律可知反应为6Na2FeO2+NaNO2+5H2O=3Na2Fe2O4+NH3↑+7NaOH,H2O的化学计量数为5,故B错误;
C.反应③中各元素的化合价不变,不属于氧化还原反应,故C错误;
D.①②中存在元素的化合价变化,③中没有元素的化合价变化,则以上三个反应不都是氧化还原反应,故D错误;
故选A.
点评:本题考查氧化还原反应,注意利用元素的化合价及相关信息来解答,明确元素的化合价变化是解答的关键,题目难度不大.

练习册系列答案
相关题目
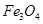 (也可表示为
(也可表示为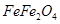 )薄膜,保护内部金属免受腐蚀,这种方法叫做烤蓝。烤蓝时发生如下反应:
)薄膜,保护内部金属免受腐蚀,这种方法叫做烤蓝。烤蓝时发生如下反应: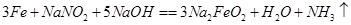
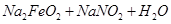 ——
——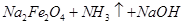 (未配平)
(未配平)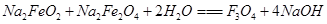
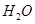 的化学计量数为3
的化学计量数为3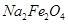 是氧化剂,
是氧化剂,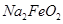 是还原剂
是还原剂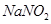 的氧化性比
的氧化性比