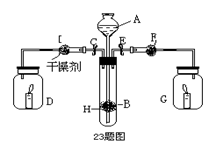
题目内容
用金属钠制取Na2O通常采用下法:2NaNO2+6Na=4Na2O+N2↑根据要求回答问题:
(1)不采用Na在氧气中燃烧获得Na2O的原因是 。
(2)上述方法的优点是 。
(1)不采用Na在氧气中燃烧获得Na2O的原因是 。
(2)上述方法的优点是 。
(1)Na在氧气中燃烧生成物是Na2O2,不生成Na2O;
(2)生成的氮气将生成的氧化钠与空气隔绝,防止了外界环境的干扰,生成的氧化钠不会变质
(2)生成的氮气将生成的氧化钠与空气隔绝,防止了外界环境的干扰,生成的氧化钠不会变质
【错解分析】明确化学反应的原理和实质,不能生搬硬套。
【正解】在评价一种制备方法优缺点时,通常从如下几个方面考虑:首先反应原理可行,其次在方案可行的情况下从反应物、产物、反应条件三角度分析,包括原料来源广泛、无污染、实验条件容易达到等方面。

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目


 试回答下列问题:
试回答下列问题: